Кремний - Silicon
| Кремний | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | |||||||||||||||||||||||||||||||
| Появление | кристаллический, отражающий с голубоватыми гранями | ||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (Si) | [28.084 , 28.086 ] условный: 28,085 | ||||||||||||||||||||||||||||||
| Кремний в периодической таблице | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 14 | ||||||||||||||||||||||||||||||
| Группа | группа 14 (углеродная группа) | ||||||||||||||||||||||||||||||
| Период | период 3 | ||||||||||||||||||||||||||||||
| Блокировать | p-блок | ||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Ne ] 3s 2 3p 2 | ||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 4 | ||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||
| Фаза на СТП | твердый | ||||||||||||||||||||||||||||||
| Температура плавления | 1687 К (1414 ° С, 2577 ° F) | ||||||||||||||||||||||||||||||
| Точка кипения | 3538 К (3265 ° С, 5909 ° F) | ||||||||||||||||||||||||||||||
| Плотность (около rt ) | 2,3290 г / см 3 | ||||||||||||||||||||||||||||||
| в жидком состоянии (при т. пл. ) | 2,57 г / см 3 | ||||||||||||||||||||||||||||||
| Теплота плавления | 50,21 кДж / моль | ||||||||||||||||||||||||||||||
| Теплота испарения | 383 кДж / моль | ||||||||||||||||||||||||||||||
| Молярная теплоемкость | 19,789 Дж / (моль · К) | ||||||||||||||||||||||||||||||
Давление газа
| |||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||
| Состояния окисления | −4 , −3, −2, −1, 0, +1, +2, +3, +4 ( амфотерный оксид) | ||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,90 | ||||||||||||||||||||||||||||||
| Энергии ионизации | |||||||||||||||||||||||||||||||
| Радиус атома | эмпирический: 111 пм | ||||||||||||||||||||||||||||||
| Ковалентный радиус | 111 вечера | ||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 210 вечера | ||||||||||||||||||||||||||||||
| Спектральные линии кремния | |||||||||||||||||||||||||||||||
| Прочие свойства | |||||||||||||||||||||||||||||||
| Естественное явление | изначальный | ||||||||||||||||||||||||||||||
| Кристальная структура | гранецентрированной алмаз кубической | ||||||||||||||||||||||||||||||
| Скорость звука тонкого стержня | 8433 м / с (при 20 ° C) | ||||||||||||||||||||||||||||||
| Тепловое расширение | 2,6 мкм / (м⋅K) (при 25 ° C) | ||||||||||||||||||||||||||||||
| Теплопроводность | 149 Вт / (м⋅K) | ||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 2,3 × 10 3 Ом⋅м (при 20 ° C) | ||||||||||||||||||||||||||||||
| Ширина запрещенной зоны | 1,12 эВ (при 300 К) | ||||||||||||||||||||||||||||||
| Магнитный заказ | диамагнитный | ||||||||||||||||||||||||||||||
| Молярная магнитная восприимчивость | -3,9 × 10 -6 см 3 / моль (298 К) | ||||||||||||||||||||||||||||||
| Модуль для младших | 130–188 ГПа | ||||||||||||||||||||||||||||||
| Модуль сдвига | 51–80 ГПа | ||||||||||||||||||||||||||||||
| Объемный модуль | 97,6 ГПа | ||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0,064–0,28 | ||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 6.5 | ||||||||||||||||||||||||||||||
| Количество CAS | 7440-21-3 | ||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||
| Именование | после латинского "silx" или "silicis", что означает кремень | ||||||||||||||||||||||||||||||
| Прогноз | Антуан Лавуазье (1787) | ||||||||||||||||||||||||||||||
| Открытие и первая изоляция | Йенс Якоб Берцелиус (1823) | ||||||||||||||||||||||||||||||
| Названный | Томас Томсон (1817) | ||||||||||||||||||||||||||||||
| Основные изотопы кремния | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Кремний - это химический элемент с символом Si и атомным номером 14. Это твердое, хрупкое кристаллическое твердое вещество с сине-серым металлическим блеском, четырехвалентный металлоид и полупроводник . Он входит в группу 14 периодической таблицы: углерод находится над ним; ниже - германий , олово , свинец и флеровий . Он относительно инертный. Из-за его высокого химического сродства к кислороду только в 1823 году Йонс Якоб Берцелиус смог впервые приготовить его и охарактеризовать в чистом виде. Его оксиды образуют семейство анионов, известных как силикаты . Его температуры плавления и кипения 1414 ° C и 3265 ° C соответственно являются вторыми по величине среди всех металлоидов и неметаллов, уступая только бору . Кремний - восьмой самый распространенный элемент во Вселенной по массе, но очень редко встречается в чистом виде в земной коре. Он наиболее широко распространен в космосе в космической пыли , на планетоидах и планетах в виде различных форм диоксида кремния (кремнезема) или силикатов . Более 90% земной коры состоит из силикатных минералов , что делает кремний вторым по распространенности элементом в земной коре (около 28% по массе) после кислорода . Кремний - это природный элемент, который, если раньше не присутствовал, находится в Мировом океане около 400 лет.
Большая часть кремния используется в коммерческих целях без разделения и часто с очень незначительной переработкой природных минералов. Такое использование включает промышленное строительство с использованием глины , кварцевого песка и камня . Силикаты используются в портландцементе для изготовления строительного раствора и штукатурки и смешиваются с кварцевым песком и гравием для изготовления бетона для пешеходных дорожек, фундаментов и дорог. Они также используются в производстве белой керамики, такой как фарфор , и в традиционном натриево-известковом стекле на силикатной основе и многих других специальных стеклах . Соединения кремния, такие как карбид кремния , используются в качестве абразивов и компонентов высокопрочной керамики. Кремний является основой широко используемых синтетических полимеров, называемых силиконами .
Конец 20-го века - начало 21-го века был описан как эпоха кремния (также известная как эпоха цифровых технологий или информационная эпоха ) из-за того, что элементарный кремний оказал большое влияние на современную мировую экономику. Относительно небольшая часть элементарного кремния очень высокой степени очистки, используемого в полупроводниковой электронике (<10%), необходима для транзисторов металл-оксид-полупроводник (МОП) и микросхем интегральных схем, используемых в большинстве современных технологий (таких как компьютеры и сотовые телефоны , для пример). Наиболее широко используемым кремниевым устройством является MOSFET ( полевой транзистор металл-оксид-полупроводник), которого было произведено больше, чем любое другое устройство в истории. Свободный кремний также используется в рафинировании стали , литье алюминия и тонкой химической промышленности (часто для производства коллоидного кремнезема ).
Кремний - важный элемент биологии, хотя животным нужны только следы. Однако различные морские губки и микроорганизмы, такие как диатомеи и радиолярии , выделяют скелетные структуры из кремнезема. Кремнезем откладывается во многих тканях растений.
История
Из-за обилия кремния в земной коре природные материалы на основе кремния использовались на протяжении тысяч лет. Кремниевые горные кристаллы были известны различным древним цивилизациям , таким как додинастические египтяне, которые использовали их для изготовления бус и небольших ваз , а также древние китайцы . Стекло, содержащее кремнезем, производилось египтянами, по крайней мере, с 1500 г. до н.э., а также древними финикийцами . Природные силикатные соединения также использовались в различных типах строительных растворов для строительства ранних человеческих жилищ .
Открытие

В 1787 году Антуан Лавуазье подозревал, что диоксид кремния может быть оксидом основного химического элемента , но химическое сродство кремния к кислороду достаточно велико, и у него не было средств для восстановления оксида и выделения элемента. После попытки изолят кремния в 1808 году, сэр Хэмфри Дэви предложил название «кремний» для кремния, от латинского Silex , silicis для кремня, и добавив «-ium» окончание , потому что он считал , что это будет металлом. В большинстве других языков используются транслитерированные формы имени Дэви, иногда адаптированные к местной фонологии (например, немецкий Silizium , турецкий silisyum , каталонский silici ). Некоторые другие используют вместо этого кальку латинского корня (например, русский кремний от кремень «кремень»; греческий πυρίτιο от πυρ «огонь»; финский pii от piikivi «кремень», чешский křemík от křemen «кварц», «кремень»). .
Считается , что Гей-Люссак и Тенар получили нечистый аморфный кремний в 1811 году путем нагревания недавно выделенного металлического калия с тетрафторидом кремния , но они не очистили и не охарактеризовали продукт, а также не идентифицировали его как новый элемент. Современное название кремнию дал в 1817 году шотландский химик Томас Томсон . Он сохранил часть имени Дэви, но добавил «-он», потому что считал кремний неметаллом, похожим на бор и углерод . В 1823 году Йенс Якоб Берцелиус приготовил аморфный кремний, используя примерно тот же метод, что и Гей-Люссак (восстановление фторосиликата калия расплавленным металлическим калием), но очистил продукт до коричневого порошка путем его многократной промывки. В результате ему обычно приписывают открытие элемента. В том же году Берцелиус стал первым, кто приготовил тетрахлорид кремния ; Тетрафторид кремния был получен задолго до 1771 года Карлом Вильгельмом Шееле путем растворения кремнезема во фтористоводородной кислоте .
Кремний в его более распространенной кристаллической форме был получен Девилем лишь 31 год спустя . Путем электролиза смеси хлорида натрия и хлорида алюминия , содержащего приблизительно 10% кремния, он смог получить слегка нечистого аллотроп кремния в 1854. Позже, более экономически эффективные методы были разработаны , чтобы выделить несколько аллотроп форм, что в последнее время силицен в 2010 году. Тем временем исследования химии кремния продолжались; Фридрих Велер обнаружил первые летучие гидриды кремния, синтезируя трихлорсилан в 1857 году и сам силан в 1858 году, но подробное исследование силанов было проведено только в начале 20 века Альфредом Штоком , несмотря на ранние предположения по этому поводу, относящиеся к далекому прошлому. как начало синтетической органической химии в 1830-х годах.> Greenwood and Earnshaw, pp. 337–340 </ref> Аналогичным образом, первое кремнийорганическое соединение , тетраэтилсилан, было синтезировано Чарльзом Фриделем и Джеймсом Крафтсом в 1863 году, но детально охарактеризовано кремнийорганическое соединение химией занимался только в начале 20 века Фредерик Киппинг .
Начиная с 1920-х годов, работа Уильяма Лоуренса Брэгга по рентгеновской кристаллографии успешно прояснила состав силикатов, который ранее был известен из аналитической химии, но еще не был понят, вместе с разработками Линуса Полинга в области кристаллохимии и Виктор Гольдшмидт в развитии геохимии . В середине 20-го века произошло развитие химии и промышленного использования силоксанов, а также рост использования силиконовых полимеров , эластомеров и смол . В конце 20 - го века, сложность кристаллической химии силицидов был картирован, наряду с физикой твердого тела из легированных полупроводников .
Кремниевые полупроводники

Первые полупроводниковые приборы не использовали кремний, но использовали галенит , в том числе немецкий физик Фердинанд Браун «ы кристалла детектора в 1874 году и Индийский физик Джагадиш Чандра Бозе » ы радио кристаллического детектора в 1901. Первый кремния полупроводникового устройства был кремниевый детектор радио кристалл, разработан американским инженером Гринлифом Уиттиером Пикардом в 1906 году.
В 1940 году Рассел Ол открыл pn-переход и фотоэлектрические эффекты в кремнии. В 1941 году во время Второй мировой войны были разработаны методы производства кристаллов германия и кремния высокой чистоты для кристаллов микроволновых детекторов радаров . В 1947 году физик Уильям Шокли выдвинул теорию о полевом усилителе, сделанном из германия и кремния, но ему не удалось построить работающее устройство, прежде чем вместо этого он начал работать с германием. Первым работающим транзистором был точечный транзистор, построенный Джоном Бардином и Уолтером Браттейном позже в том же году, работая под руководством Шокли. В 1954 году физико-химик Моррис Таненбаум изготовил первый кремниевый транзистор в Bell Labs . В 1955 году Карл Фрош и Линкольн Дерик из Bell Labs случайно обнаружили, что диоксид кремния (SiO 2 ) можно выращивать на кремнии, и позже они предположили, что это может маскировать кремниевые поверхности во время процессов диффузии в 1958 году.
В первые годы полупроводниковой промышленности , вплоть до конца 1950-х годов, германий был доминирующим полупроводниковым материалом для транзисторов и других полупроводниковых устройств, а не кремний. Первоначально германий считался более эффективным полупроводниковым материалом, так как он мог продемонстрировать лучшие характеристики из-за более высокой подвижности носителей . Относительная неэффективность ранних кремниевых полупроводников объяснялась тем, что электрическая проводимость ограничивалась нестабильными квантовыми состояниями поверхности , когда электроны захватываются на поверхности, из-за оборванных связей, которые возникают из-за ненасыщенных связей на поверхности. Это препятствовало тому, чтобы электричество надежно проникало через поверхность и достигало слоя полупроводящего кремния.
Прорыв в кремниевой полупроводниковой технологии , пришел с работы египетского инженера Мухамеда М. Atalla , который разработал процесс пассивации поверхности путем термического окисления в Bell Labs в конце 1950 - х годов. Он обнаружил, что образование термически выращенного слоя диоксида кремния значительно снижает концентрацию электронных состояний на поверхности кремния, и что слои оксида кремния могут использоваться для электрической стабилизации поверхностей кремния. Аталла впервые опубликовал свои выводы в записках Белла в 1957 году, а затем продемонстрировал их в 1958 году. Это была первая демонстрация, показавшая, что высококачественные изолирующие пленки из диоксида кремния могут быть выращены термически на поверхности кремния для защиты находящихся под ними кремниевых диодов с p-n-переходом и транзисторы. Процесс пассивации поверхности Аталлы позволил кремнию превзойти по проводимости и характеристикам германий и привел к тому, что кремний заменил германий в качестве доминирующего полупроводникового материала, проложив путь кремниевой революции. Процесс пассивации поверхности Аталлы считается наиболее важным достижением в технологии кремниевых полупроводников, открывающим путь для массового производства кремниевых полупроводниковых устройств.
Новаторская работа Аталлы по пассивации поверхности и термическому окислению завершилась его изобретением MOSFET ( полевой транзистор металл-оксид-кремний) вместе с его корейским коллегой Давоном Кангом в 1959 году. MOSFET был первым массово производимым кремниевым транзистором. и ему приписывают начало кремниевой революции. Кроме того, процесс пассивации поверхности Atalla была основой для двух других важно кремниевых полупроводниковых изобретений в Fairchild Semiconductor , швейцарский инженер Жан Хоерни «s планарной технологии в 1958 году и американский физик Роберт Нойс » кремния с интегральной схемой чипа в 1959 г. Это , в свою очередь , привело к Аталла в 1960 году предложил концепцию МОП-интегральной схемы, кремниевого чипа, построенного из полевых МОП-транзисторов, который позже стал стандартным процессом изготовления полупроводниковых устройств для интегральных схем. К середине 1960-х процесс Аталлы для окисленных кремниевых поверхностей использовался для изготовления практически всех интегральных схем и кремниевых устройств.
Кремниевый век
«Кремниевый век» относится к концу 20 века - началу 21 века. Это связано с тем, что кремний был доминирующим материалом Кремниевого века (также известного как цифровой век или информационный век ), подобно тому, как каменный век , бронзовый век и железный век определялись доминирующими материалами в соответствующие эпохи цивилизации .
Ключевым компонентом или «рабочей лошадкой» кремниевой революции (также известной как цифровая революция или информационная революция ) является кремниевый MOSFET ( полевой транзистор металл-оксид-кремний). Это был первый по-настоящему компактный транзистор, который можно было миниатюризировать и выпускать серийно для широкого спектра применений. Начало кремниевой революции датируется 1960 годом, когда Мохамед М. Аталла и Давон Кан впервые продемонстрировали свое изобретение полевого МОП-транзистора. С тех пор массовое производство кремниевых МОП-транзисторов и интегральных схем МОП-транзисторов , наряду с непрерывной масштабной миниатюризацией МОП-транзисторов с экспоненциальной скоростью (как это предсказывается законом Мура ), привело к революционным изменениям в технологии, экономике, культуре и мышлении. С тех пор полевой МОП-транзистор стал самым широко производимым устройством в истории: в период с 1960 по 2018 год было произведено в общей сложности 13 секстиллионов полевых МОП-транзисторов.
Поскольку кремний является важным элементом в высокотехнологичных полупроводниковых устройствах, многие места в мире носят его название. Например, долина Санта-Клара в Калифорнии получила прозвище « Силиконовая долина» , поскольку этот элемент является основным материалом в полупроводниковой промышленности . С тех пор многие другие места получили аналогичные названия, включая Кремниевый лес в Орегоне , Кремниевые холмы в Остине, Техас , Кремниевые склоны в Солт-Лейк-Сити, Юта , Кремниевую Саксонию в Германии, Кремниевую долину в Индии, Кремниевую границу в Мехикали, Мексика , Кремниевый болот в Кембридже, Англия , Кремниевый карусель в Лондоне, Кремниевая долина в Шотландии, Кремниевое ущелье в Бристоле, Англия , Кремниевая аллея в Нью-Йорке, Нью-Йорке и Кремниевый пляж в Лос-Анджелесе, Калифорния .
Характеристики
Физический и атомный
У атома кремния четырнадцать электронов . В основном состоянии они расположены в электронной конфигурации [Ne] 3s 2 3p 2 . Из них четыре являются валентными электронами , занимающими 3s-орбиталь, и два из 3p-орбиталей. Как и другие члены его группы, более легкий углерод и более тяжелый германий , олово и свинец , он имеет то же количество валентных электронов, что и валентные орбитали: следовательно, он может завершить свой октет и получить стабильную конфигурацию благородного газа аргона с помощью образуя sp 3 гибридные орбитали , формируя тетраэдрические производные SiX 4 , в которых центральный атом кремния разделяет электронную пару с каждым из четырех атомов, с которыми он связан. Первые четыре энергии ионизации кремния составляют 786,3, 1576,5, 3228,3 и 4354,4 кДж / моль соответственно; эти цифры достаточно высоки, чтобы исключить возможность простой катионной химии элемента. Согласно периодическим тенденциям , его ковалентный радиус с одинарной связью 117,6 пм является промежуточным между радиусом углерода (77,2 пм) и германия (122,3 пм). Гексакоординированный ионный радиус кремния можно считать равным 40 пм, хотя это следует рассматривать как чисто условную цифру, учитывая отсутствие в действительности простого катиона Si 4+ .
Электрические
При стандартной температуре и давлении кремний представляет собой блестящий полупроводник с голубовато-серым металлическим блеском; что типично для полупроводников, его удельное сопротивление падает с ростом температуры. Это происходит потому, что кремний имеет небольшую ширину запрещенной зоны (запрещенную зону ) между самыми высокими заполненными уровнями энергии (валентная зона) и самыми низкими незанятыми (зона проводимости). Уровень Ферми находится примерно на полпути между валентной зоной и зоной проводимости и представляет собой энергию, при которой состояние с большей вероятностью будет занято электроном, чем нет. Следовательно, чистый кремний является эффективным изолятором при комнатной температуре. Однако легирование кремния пниктогеном, таким как фосфор , мышьяк или сурьма, вводит один дополнительный электрон на одну добавку, и они затем могут быть возбуждены в зоне проводимости термически или фотолитически, создавая полупроводник n-типа . Точно так же легирование кремния элементом группы 13, таким как бор , алюминий или галлий, приводит к появлению акцепторных уровней, которые захватывают электроны, которые могут быть возбуждены из заполненной валентной зоны, создавая полупроводник p-типа . ((Соединение кремния n-типа с кремнием p-типа создает pn-переход с общим уровнем Ферми; электроны текут от n к p, а дырки текут от p к n, создавая падение напряжения. Таким образом, pn-переход действует как диод который может выпрямлять переменный ток, что позволяет току проходить легче в одну сторону, чем в другую.Транзистор представляет собой npn-переход с тонким слоем кремния слабого p-типа между двумя областями n-типа. Смещение эмиттера через небольшое прямое напряжение а коллектор через большое обратное напряжение позволяет транзистору действовать как триодный усилитель.
Кристальная структура
Кремний кристаллизуется в гигантской ковалентной структуре при стандартных условиях, в частности в кубической решетке алмаза ( пространственная группа 227 ). Таким образом, он имеет высокую температуру плавления 1414 ° C, так как требуется много энергии для разрыва прочных ковалентных связей и плавления твердого вещества. При плавлении кремний сжимается, поскольку дальнодействующая тетраэдрическая сеть связей распадается, и пустоты в этой сети заполняются, подобно водяному льду, когда водородные связи разрываются при плавлении. Он не имеет термодинамически стабильных аллотропов при стандартном давлении, но известно несколько других кристаллических структур при более высоких давлениях. Общая тенденция - это тенденция увеличения координационного числа с давлением, достигающего высшей точки в гексагональном плотноупакованном аллотропе с плотностью около 40 гигапаскалей, известном как Si-VII (стандартная модификация - Si-I). Аллотроп под названием BC8 (или bc8), имеющий объемно -центрированную кубическую решетку с восемью атомами на примитивную элементарную ячейку ( пространственная группа 206 ), может быть создан при высоком давлении и остается метастабильным при низком давлении. Его свойства подробно изучены.
Кремний кипит при 3265 ° C: эта температура, хотя и высокая, все же ниже, чем температура, при которой его более легкий родственный углерод сублимируется (3642 ° C), и кремний аналогично имеет более низкую теплоту испарения, чем углерод, что согласуется с тем фактом, что Si– Связь Si слабее, чем связь C – C.
Также возможно построить слои силицена, аналогичные графену .
Изотопы
Встречающийся в природе кремний состоит из трех стабильных изотопов : 28 Si (92,23%), 29 Si (4,67%) и 30 Si (3,10%). Из них только 29 Si используется в спектроскопии ЯМР и ЭПР , так как это единственный Si с ядерным спином ( I =1/2). Все три образуются в сверхновых типа Ia в процессе сжигания кислорода , причем 28 Si образуется в рамках альфа-процесса и, следовательно, является наиболее распространенным. Слияние 28 Si с альфа-частицами путем фотораспадающейся перегруппировки в звездах известно как процесс горения кремния ; это последняя стадия звездного нуклеосинтеза перед быстрым коллапсом и сильным взрывом рассматриваемой звезды в сверхновой типа II .
Было охарактеризовано двадцать радиоизотопов , два из которых наиболее стабильны: 32 Si с периодом полураспада около 150 лет и 31 Si с периодом полураспада 2,62 часа. Все оставшиеся радиоактивные изотопы имеют период полураспада менее семи секунд, а у большинства из них период полураспада составляет менее одной десятой секунды. Кремний имеет один известный ядерный изомер , 34m Si, с периодом полураспада менее 210 наносекунд. 32 Si , подвергается низкоэнергетического бета - распада с 32 P , а затем стабильной 32 S . 31 Si может быть получен нейтронной активацией природного кремния и, таким образом, полезен для количественного анализа; его можно легко обнаружить по характерному бета-распаду до стабильного 31 P , в котором испускаемый электрон переносит энергию до 1,48 МэВ .
Известные изотопы кремния имеют массовое число от 22 до 44. Наиболее распространенный способ распада изотопов с массовыми числами ниже, чем у трех стабильных изотопов, - это обратный бета-распад , в основном с образованием изотопов алюминия (13 протонов) в качестве продуктов распада . Наиболее распространенным способом распада более тяжелых нестабильных изотопов является бета-распад, при котором в качестве продуктов распада образуются в основном изотопы фосфора (15 протонов).
Кремний может попадать в океаны через грунтовые воды и речной транспорт. Большие потоки поступления подземных вод имеют изотопный состав, отличный от поступлений кремния в речных водах. Изотопные вариации в грунтовых водах и речном переносе вносят вклад в вариации в значениях 30 Si в океане . В настоящее время наблюдаются существенные различия в изотопных значениях глубоководных бассейнов Мирового океана. Между Атлантическим и Тихим океанами существует глубинный градиент 30 Si, превышающий 0,3 частей на тысячу. 30 Si чаще всего ассоциируется с продуктивностью океанов.
Химия и соединения
| X = | C | Si | ЧАС | F | Cl | Br | я | O– | N < |
|---|---|---|---|---|---|---|---|---|---|
| C – X | 368 | 360 | 435 | 453 | 351 | 293 | 216 | ~ 360 | ~ 305 |
| Шесть | 360 | 340 | 393 | 565 | 381 | 310 | 234 | 452 | 322 |
Объемный кристаллический кремний довольно инертен, но становится более активным при высоких температурах. Как и соседний алюминий, кремний образует тонкий непрерывный поверхностный слой диоксида кремния (SiO 2 ), который защищает металл от окисления. Таким образом, кремний практически не реагирует с воздухом при температуре ниже 900 ° C, но образование стекловидного диоксида быстро увеличивается между 950 ° C и 1160 ° C, а при достижении 1400 ° C атмосферный азот также реагирует с образованием нитридов SiN и Si 3. № 4 . Кремний реагирует с газообразной серой при 600 ° C и газообразным фосфором при 1000 ° C. Тем не менее этот оксидный слой не препятствует реакции с галогенами ; фтор активно атакует кремний при комнатной температуре, хлор - примерно при 300 ° C, а бром и йод - примерно при 500 ° C. Кремний не реагирует с большинством водных кислот, но окисляется и образует комплексы смесями фтористоводородной кислоты, содержащими хлор или азотную кислоту, с образованием гексафторсиликатов . Он легко растворяется в горячей водной щелочи с образованием силикатов . При высоких температурах кремний также реагирует с алкилгалогенидами ; эта реакция может катализироваться медью с прямым синтезом кремнийорганических хлоридов в качестве предшественников силиконовых полимеров. При плавлении кремний становится чрезвычайно реактивным, сплавляясь с большинством металлов с образованием силицидов и восстанавливая большинство оксидов металлов, потому что теплота образования диоксида кремния очень велика. В результате емкости для жидкого кремния должны изготавливаться из тугоплавких , инертных материалов, таких как диоксид циркония или бориды групп 4, 5 и 6.
Тетраэдрическая координация является основным структурным мотивом в химии кремния, так же как и в химии углерода. Однако подоболочка 3p является более диффузной, чем подоболочка 2p, и не так хорошо гибридизируется с подоболочкой 3s. В результате химический состав кремния и его более тяжелых родственных соединений существенно отличается от химического состава углерода, и, следовательно, октаэдрическая координация также имеет большое значение. Например, электроотрицательность кремния (1,90) намного меньше, чем у углерода (2,55), потому что валентные электроны кремния находятся дальше от ядра, чем электроны углерода, и, следовательно, испытывают меньшие электростатические силы притяжения от ядра. Плохое перекрытие 3p-орбиталей также приводит к гораздо меньшей тенденции к катенации (образованию связей Si – Si) для кремния, чем для углерода, из-за сопутствующего ослабления связи Si – Si по сравнению со связью C – C: в среднем Энергия связи Si – Si составляет приблизительно 226 кДж / моль по сравнению со значением 356 кДж / моль для связи C – C. Это приводит к тому, что соединения кремния с множественными связями обычно намного менее стабильны, чем их углеродные аналоги, что является примером правила двойной связи . С другой стороны, наличие радиальных узлов на 3p-орбиталях кремния предполагает возможность гипервалентности , как видно в пяти- и шестикоординатных производных кремния, таких как SiX-
5и SiF2-
6. Наконец, из-за увеличения энергетической щели между валентными s- и p-орбиталями по мере спуска группы важность двухвалентного состояния возрастает от углерода к свинцу, так что для кремния известно несколько нестабильных двухвалентных соединений; это понижение основной степени окисления в сочетании с увеличением атомных радиусов приводит к усилению металлического характера вниз по группе. Кремний уже демонстрирует некоторое зарождающееся металлическое поведение, особенно в поведении его оксидных соединений и его реакции с кислотами, а также с основаниями (хотя это требует определенных усилий), и поэтому его часто называют металлоидом, а не неметаллом. Однако металличность не проявляется в группе 14 до германия и преобладает до олова, с возрастающей важностью более низкой степени окисления +2.
Кремний показывает явные отличия от углерода. Например, органическая химия имеет очень мало аналогий с химией кремния, в то время как силикатные минералы имеют структурную сложность, невидимую для оксоуглеродов. Greenwood and Earnshaw, pp. 328–329 </ref> Кремний больше похож на германий, чем на углерод, и это сходство усиливается сжатием d-блока , в результате чего размер атома германия намного ближе к размеру атома кремния, чем можно было бы прогнозировать по периодическим тенденциям. Тем не менее, все еще есть некоторые различия из-за растущей важности двухвалентного состояния в германии по сравнению с кремнием, что приводит к тому, что германий является значительно более металлическим, чем кремний. Кроме того, более низкая прочность связи Ge – O по сравнению с прочностью связи Si – O приводит к отсутствию «германоновых» полимеров, которые были бы аналогичны силиконовым полимерам.
Силициды
Известны многие силициды металлов , большинство из которых имеют формулы, которые нельзя объяснить простыми обращениями к валентности : их связь варьируется от металлической до ионной и ковалентной . Некоторые известные стехиометрии: M 6 Si, M 5 Si, M 4 Si, M 15 Si 4 , M 3 Si, M 5 Si 2 , M 2 Si, M 5 Si 3 , M 3 Si 2 , MSi, M 2 Si 3. , MSi 2 , MSi 3 и MSi 6 . Они структурно больше похожи на бориды, чем на карбиды , в соответствии с диагональным соотношением между бором и кремнием, хотя больший размер кремния, чем бор, означает, что точные структурные аналогии немногочисленны и далеки друг от друга. Теплоты образования силицидов обычно аналогичны теплотам образования боридов и карбидов тех же элементов, но они обычно плавятся при более низких температурах. Силициды известны для всех стабильных элементов 1–10 групп, за исключением бериллия : в частности, уран и переходные металлы 4–10 групп имеют самый широкий диапазон стехиометрий. Металлы 11–15 групп, за исключением меди , силицидов не образуют. Вместо этого большинство из них образуют эвтектические смеси , хотя самые тяжелые постпереходные металлы - ртуть , таллий , свинец и висмут - полностью не смешиваются с жидким кремнием.
Обычно силициды получают путем прямой реакции элементов. Например, щелочные металлы и щелочноземельные металлы реагируют с кремнием или оксидом кремния с образованием силицидов. Тем не менее, даже с этими высоко электроположительными элементами нельзя получить истинные анионы кремния, и большинство этих соединений являются полупроводниками. Например, силициды щелочных металлов (M+
)
4(Si4-
4) содержат пирамидальный трехкоординатный кремний в Si4-
4анион, изоэлектронный с белым фосфором , P 4 . Богатые металлами силициды обычно имеют изолированные атомы кремния (например, Cu 5 Si); с увеличением содержания кремния катенация увеличивается, в результате сначала образуются изолированные кластеры из двух (например, U 3 Si 2 ) или четырех атомов кремния (например, [K + ] 4 [Si 4 ] 4– ), за которыми следуют цепочки (например, CaSi), слоев (например, CaSi 2 ) или трехмерных сетей атомов кремния, охватывающих пространство (например, α-ThSi 2 ), когда содержание кремния возрастает еще выше.
Силициды металлов 1 и 2 групп обычно более реакционноспособны, чем силициды переходных металлов. Последние обычно не реагируют с водными реагентами, за исключением плавиковой кислоты ; однако они реагируют с гораздо более агрессивными реагентами, такими как жидкий гидроксид калия или газообразный фтор или хлор, когда они раскалены докрасна. Силициды пре-переходных металлов вместо этого легко реагируют с водой и водными кислотами, обычно с образованием водорода или силанов:
- Na 2 Si + 3 H 2 O → Na 2 SiO 3 + 3 H 2
- Mg 2 Si + 2 H 2 SO 4 → 2 MgSO 4 + SiH 4
Продукты часто различаются в зависимости от стехиометрии силицидного реагента. Например, Ca 2 Si является полярным и непроводящим, имеет структуру анти-PbCl 2 с отдельными изолированными атомами кремния и реагирует с водой с образованием гидроксида кальция , гидратированного диоксида кремния и газообразного водорода. CaSi с его зигзагообразными цепочками атомов кремния вместо этого реагирует с образованием силанов и полимерного SiH 2 , в то время как CaSi 2 с его сморщенными слоями атомов кремния не реагирует с водой, но будет реагировать с разбавленной соляной кислотой: продукт представляет собой желтое полимерное твердое вещество с стехиометрия Si 2 H 2 O.
Силаны
Спекуляции на тему химии гидрида кремния начались в 1830-х годах, одновременно с развитием синтетической органической химии . Силан себя, а также трихлорсилана , были впервые синтезированы Фридриха Вёлер и Heinrich Буфф в 1857 году путем взаимодействия алюминиево-кремниевых сплавов с соляной кислотой , и характеризуется как SiH 4 и SiHCl 3 от Чарльза Фриделя и Альберта Ладенбург в 1867. дисилан (Si 2 Н 6 ) , а затем в 1902 году, когда она была впервые сделана Муассана и Смайлсом по протолизу из силицидов магния . Дальнейшие исследования пришлось отложить до 1916 г. из-за большой реакционной способности и термической нестабильности силанов; Именно тогда Альфред Сток начал всерьез изучать гидриды кремния с помощью новых вакуумных технологий без смазки, поскольку они были обнаружены в качестве загрязняющих веществ в его фокусе - гидридах бора . Названия силанов и боранов принадлежат ему по аналогии с алканами . Метод Муассана и Смайлса получения силанов и производных силана посредством протонолиза силицидов металлов все еще используется, хотя выход снижается за счет гидролиза продуктов, который происходит одновременно, поэтому сегодня предпочтительным путем является обработка замещенных силанов гидридным восстановителем. такие агенты, как алюмогидрид лития, в эфирных растворах при низких температурах. Прямая реакция HX или RX с кремнием, возможно, с катализатором, таким как медь, также является жизнеспособным методом получения замещенных силанов.
Силаны представляют собой гомологичный ряд гидридов кремния с общей формулой Si n H 2 n + 2 . Все они сильные восстановители . Неразветвленные и разветвленные цепи известны вплоть до n = 8, а также известны циклы Si 5 H 10 и Si 6 H 12 . Первые два, силан и дисилан, представляют собой бесцветные газы; более тяжелые члены этого ряда - летучие жидкости. Все силаны очень реактивны и воспламеняются или самопроизвольно взрываются в воздухе. Они становятся менее термически стабильными при комнатной температуре, так что только силан неопределенно стабилен при комнатной температуре, хотя дисилан не разлагается очень быстро (только 2,5% образца разлагается по прошествии восьми месяцев). Они разлагаются с образованием полимерного гидрида поликремния и газообразного водорода. Как и следовало ожидать из разницы в атомном весе, силаны менее летучие, чем соответствующие алканы и бораны, но в большей степени, чем соответствующие германы. Они гораздо более реакционноспособны, чем соответствующие алканы, из-за большего радиуса кремния по сравнению с углеродом, способствующего нуклеофильной атаке на кремний, большей полярности связи Si – H по сравнению со связью C – H и способности кремния к расширяет свой октет и, следовательно, образует аддукты и снижает энергию активации реакции .
Пиролиз силана дает полимерные частицы и, наконец, элементарный кремний и водород; действительно, сверхчистый кремний коммерчески производится пиролизом силана. В то время как термическое разложение алканов начинается с разрыва связи C – H или C – C и образования радикальных промежуточных продуктов, полисиланы разлагаются за счет удаления силиленов : SiH 2 или: SiHR, как энергия активации этого процесса (~ 210 кДж). / моль) намного меньше энергий связей Si – Si и Si – H. Хотя чистые силаны не вступают в реакцию с чистой водой или разбавленными кислотами, следы щелочи катализируют немедленный гидролиз до гидратированного диоксида кремния. Если реакцию проводят в метаноле , контролируемый сольволиз приводит к образованию продуктов SiH 2 (OMe) 2 , SiH (OMe) 3 и Si (OMe) 4 . Связь Si – H также присоединяется к алкенам , реакция, которая протекает медленно и ускоряется с увеличением замещения задействованного силана. При 450 ° C силан участвует в реакции присоединения с ацетоном , а также в реакции раскрытия цикла с оксидом этилена . Прямая реакция силанов с хлором или бромом приводит к взрывам при комнатной температуре, но реакция силана с бромом при -80 ° C контролируется и дает бромсилан и дибромсилан. Моногалосиланы могут быть образованы реакцией силана с соответствующим галогенидом водорода с катализатором Al 2 X 6 или реакцией силана с твердым галогенидом серебра в проточном реакторе с подогревом:
- SiH 4 + 2 AgClSiH 3 Cl + HCl + 2 Ag
Среди производных силана, иодсилан (SiH 3 I) , и silanide калия (KSiH 3 ) являются очень полезными синтетическими промежуточными продуктами при производстве более сложных соединений , содержащих кремний: последняя представляет собой бесцветные кристаллические ионные твердые , содержащие K + катионы и SiH-
3анионы в структуре NaCl , и производится восстановлением силана металлическим калием . Кроме того, реактивные гипервалентные частицы SiH-
5также известен. С помощью подходящих органических заместителей можно получать стабильные полисиланы: они обладают удивительно высокой электропроводностью, возникающей в результате сигма- делокализации электронов в цепи.
Галогениды
Кремний и карбид кремния легко реагируют со всеми четырьмя стабильными галогенами, образуя бесцветные, реакционноспособные и летучие тетрагалогениды кремния. Тетрафторид кремния также может быть получен путем фторирования других галогенидов кремния, а также путем воздействия фтористоводородной кислоты на стекло. Совместное нагревание двух разных тетрагалогенидов также дает случайную смесь смешанных галогенидов, которые также могут быть получены реакциями обмена галогенов. Температуры плавления и кипения этих веществ обычно повышаются с увеличением атомной массы, хотя есть много исключений: например, точки плавления и кипения падают при переходе от SiFBr 3 через SiFClBr 2 к SiFCl 2 Br. Переход от гипоэлектронных элементов в группе 13 и ранее к элементам группы 14 иллюстрируется переходом от бесконечной ионной структуры во фториде алюминия к решетке простых молекул ковалентного тетрафторида кремния, что продиктовано более низкой электроотрицательностью алюминия, чем кремний. стехиометрия (степень окисления +4 слишком высока для истинной ионности) и меньший размер атома кремния по сравнению с атомом алюминия. Тетрахлорид кремния производится в огромных масштабах как предшественник чистого кремния, диоксида кремния и некоторых сложных эфиров кремния . Тетрагалогениды кремния легко гидролизуются в воде, в отличие от тетрагалогенидов углерода, опять же из-за большего размера атома кремния, что делает его более уязвимым для нуклеофильной атаки, и способности атома кремния расширять свой октет, которого нет в углероде. Реакция фторида кремния с избытком фтористоводородной кислоты дает октаэдрический гексафторсиликатный анион SiF.2-
6.
Аналогичны силанам также известны галополисиланы Si n X 2 n + 2 . В то время как катенация в углеродных соединениях максимальна в соединениях водорода, а не в галогенидах, для кремния верно противоположное, так что галогенполисиланы известны по крайней мере до Si 14 F 30 , Si 6 Cl 14 и Si 4 Br 10 . Предлагаемое объяснение этого явления заключается в компенсации потерь электронов кремния более электроотрицательными атомами галогена за счет обратных связей pi от заполненных p π- орбиталей на атомах галогена к пустым d π- орбиталям на кремнии: это похоже на ситуацию с монооксид углерода в карбонильных комплексах металлов и объясняет их стабильность. Эти галополисиланы могут быть получены компропорционированием тетрагалогенидов кремния с элементарным кремнием или конденсацией более легких галополисиланов ( триметиламмоний является подходящим катализатором для этой реакции).
Кремнезем
Диоксид кремния (SiO 2 ), также известный как диоксид кремния, является одним из наиболее изученных соединений, уступающим только воде . Известно двенадцать различных кристаллических модификаций кремнезема, наиболее распространенным из которых является α- кварц , основной компонент многих горных пород, таких как гранит и песчаник . Также известно, что он встречается в чистом виде в виде горного хрусталя ; нечистые формы известны как розовый кварц , дымчатый кварц , морион , аметист и цитрин . Также известны некоторые малокристаллические формы кварца, такие как халцедон , хризопраз , сердолик , агат , оникс , яшма , гелиотроп и кремень . Другие модификации диоксида кремния известны в некоторых других минералах, таких как тридимит и кристобалит , а также в гораздо менее распространенных коэсите и стишовите . Биологически полученные формы также известны как кизельгур и диатомовая земля . Стекловидный диоксид кремния известен как тектит , обсидиан и редко - как лешательерит . Некоторые синтетические формы известны как кеатит и W-кремнезем . Опалы состоят из сложных кристаллических агрегатов частично гидратированного диоксида кремния.
Большинство кристаллических форм кремнезема состоят из бесконечного множества тетраэдров {SiO 4 } (с Si в центре), соединенных своими углами, причем каждый атом кислорода связан с двумя атомами кремния. В термодинамически стабильной форме α-кварца при комнатной температуре эти тетраэдры связаны в переплетенные спиральные цепочки с двумя различными расстояниями Si – O (159,7 и 161,7 пм) с углом Si – O – Si 144 °. Эти спирали могут быть как левыми, так и правыми, так что отдельные кристаллы α-кварца оптически активны. При 537 ° C он быстро и обратимо превращается в аналогичный β-кварц с изменением угла Si – O – Si до 155 °, но с сохранением хиральности. Дальнейший нагрев до 867 ° C приводит к другому обратимому фазовому переходу в β-тридимит, при котором некоторые связи Si – O разрываются, что позволяет организовать тетраэдры {SiO 4 } в более открытую и менее плотную гексагональную структуру. Этот переход является медленным, и, следовательно, тридимит возникает как метастабильный минерал даже ниже этой температуры перехода; при охлаждении примерно до 120 ° C он быстро и обратимо превращается за счет небольших смещений отдельных атомов кремния и кислорода в α-тридимит, аналогично переходу от α-кварца к β-кварцу. β-тридимит медленно превращается в кубический β-кристобалит при температуре около 1470 ° C, который снова существует метастабильно ниже температуры перехода и превращается при 200–280 ° C в α-кристобалит посредством небольших атомных смещений. β-кристобалит плавится при 1713 ° C; Замораживание кремнезема из расплава происходит довольно медленно, и вместо этого, вероятно, произойдет остекловывание или образование стекла . В стекловидном диоксиде кремния тетраэдры {SiO 4 } остаются соединенными по углам, но симметрия и периодичность кристаллических форм теряются. Из-за медленных превращений между этими тремя формами при быстром нагревании возможно плавление β-кварца (1550 ° C) или β-тридимита (1703 ° C). Кремнезем кипит примерно при 2800 ° C. Известны другие формы кремнезема под высоким давлением, такие как коэсит и стишовит: они известны в природе, образуются под ударным давлением при ударе метеорита, а затем быстро закаливаются, чтобы сохранить кристаллическую структуру. Подобное плавление и охлаждение кремнезема происходит после ударов молнии , образуя стеклообразный лешательерит . W-диоксид кремния представляет собой нестабильную форму с низкой плотностью, состоящую из тетраэдров {SiO 4 }, имеющих противоположные края вместо углов, образующих параллельные цепочки, аналогично дисульфиду кремния (SiS 2 ) и диселениду кремния (SiSe 2 ): он быстро возвращается к образованию аморфного диоксида кремния с тепло или следы воды
Кремнезем химически довольно инертен. Он не подвергается воздействию каких-либо кислот, кроме плавиковой кислоты. Однако он медленно растворяется в горячих концентрированных щелочах и довольно быстро растворяется в плавленых гидроксидах или карбонатах металлов с образованием силикатов металлов. Среди элементов он подвергается воздействию только фтора при комнатной температуре с образованием тетрафторида кремния: водород и углерод также вступают в реакцию, но для этого требуется температура выше 1000 ° C. Тем не менее кремнезем реагирует со многими оксидами металлов и металлоидов с образованием широкого спектра соединений, важных, прежде всего, в стекольной и керамической промышленности, но также имеет много других применений: например, силикат натрия часто используется в моющих средствах из-за его буферизации , омыления и т. Д. и эмульгирующие свойства
Кремниевые кислоты
Добавление воды к кремнезему снижает его температуру плавления примерно на 800 ° C из-за разрушения структуры за счет замены связей Si – O – Si концевыми группами Si – OH. Увеличение концентрации воды приводит к образованию гидратированных силикагелей и дисперсий коллоидного диоксида кремния. Многие гидраты и кремниевые кислоты существуют в самых разбавленных водных растворах, но они довольно нерастворимы и быстро осаждаются, конденсируются и сшиваются с образованием различных поликремниевых кислот в различных комбинациях по формуле [SiO x (OH) 4-2 x ] n , подобно поведению бора , алюминия и железа , среди других элементов. Следовательно, хотя некоторые простые кремниевые кислоты были идентифицированы в разбавленных растворах, таких как ортокремниевая кислота Si (OH) 4 и метакремниевая кислота SiO (OH) 2 , ни одна из них, вероятно, не существует в твердом состоянии.
Силикатные минералы
| CN 4 | Ли И (59) |
Be II (27) | Al III (39) | Si IV (26) | |
|---|---|---|---|---|---|
| CN 6 | Na I (102) | Мг II (72) | Al III (54) | Ti IV (61) | Fe II (78) |
| CN 8 | К И (151) | Ca II (112) | |||
| CN 12 | К И (164) |
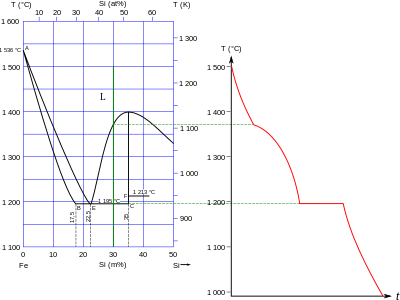
Около 95% горных пород земной коры состоят из кремнезема или силикатных и алюмосиликатных минералов, что отражено в кислороде, кремнии и алюминии, которые являются тремя наиболее распространенными элементами в коре (в указанном порядке). По массе кремний составляет 27,7% земной коры . Кристаллы чистого кремния очень редко встречаются в природе, но заметным исключением являются кристаллы размером до 0,3 мм в диаметре, обнаруженные при отборе проб газов из вулкана Кудрявый на Итурупе , одном из Курильских островов .
Силикатные и алюмосиликатные минералы имеют много различных структур и разную стехиометрию, но их можно классифицировать в соответствии с некоторыми общими принципами. Тетраэдрические звенья {SiO 4 } являются общими почти для всех этих соединений, либо в виде дискретных структур, либо объединены в более крупные звенья за счет общих угловых атомов кислорода. Они могут быть разделены на NESO -silicates (дискретный {SiO 4 } единиц) не разделяя ни одного атома кислорода, Соро -silicates (дискретный {Si 2 O 7 } единиц) обмена один, цикло -silicates (замкнутые кольцевые структуры) и ино -silicates ( непрерывная цепь или лента структура) и совместное использование два, Слоеное -silicates (непрерывные листы) обмен три, и Tecto -silicates (непрерывные трехмерный каркасы) , разделяющая четыре. Получающаяся в результате решетка атомов кислорода обычно плотно упакована или близка к ней, причем заряд уравновешивается другими катионами в различных полиэдрических узлах в зависимости от размера.
Ортосиликаты MII
2SiO
4(M = Be, Mg, Mn, Fe, Zn) и ZrSiO 4 являются несиликатами . Быть
2SiO
4( фенакит ) необычен, поскольку и Be II, и Si IV занимают тетраэдрические четырехкоординированные позиции ; другие двухвалентные катионы вместо этого занимают шестикоординированные октаэдрические позиции и часто изоморфно замещают друг друга, как в оливине , (Mg, Fe, Mn) 2 SiO 4 . Циркон , ZrSiO 4 , требует восьмикратной координации катионов Zr IV из-за стехиометрии и из-за их большего ионного радиуса (84 мкм). Также важны гранаты [MII
3MIII
2(SiO
4)
3], в котором двухвалентные катионы (например, Ca, Mg, Fe) являются восьмикоординированными, а трехвалентные - шестикоординированными (например, Al, Cr, Fe). Регулярная координация присутствует не всегда: например, она не обнаруживается в Ca 2 SiO 4 , который смешивает шести- и восьмикоординатные позиции для Ca II . Соро- силикаты, содержащие дискретные двойные или тройные тетраэдрические звенья, встречаются довольно редко: известны также метасиликаты, включающие циклические "[(SiO 3 ) n ] 2 n - " звенья примыкающих друг к другу тетраэдров, образующих многоугольное кольцо.
Цепные метасиликаты, {SiO2-
3}
∞, образующиеся при соединении углов неопределенной цепочки связанных тетраэдров {SiO 4 }. Многие различия возникают из-за различных расстояний повторения конформации по линии тетраэдров. Расстояние повторения два является наиболее распространенным, как и в большинстве минералов пироксена , но также известны расстояния повторения в один, три, четыре, пять, шесть, семь, девять и двенадцать. Эти цепи могут затем соединяться друг с другом, образуя двойные цепи и ленты, как в минералах асбеста , включая повторяющиеся цепи циклических колец тетраэдров.
Слоистые силикаты, такие как глинистые минералы и слюды , очень распространены и часто образуются путем горизонтального сшивания метасиликатных цепей или плоской конденсации более мелких единиц. Примером является каолинит [Al 2 (OH) 4 Si 2 O 5 ]; во многих из этих минералов обычны катионы и анионы, так что, например, тетраэдрический Si IV может быть заменен на Al III , октаэдрический Al III на Mg II , а OH - на F - . Алюмосиликаты трехмерного каркаса очень сложны по своей структуре; Их можно представить как исходные из структуры SiO 2 , но, заменив до половины атомов Si IV на Al III , они требуют включения большего количества катионов в структуру для балансировки заряда. Примеры включают полевой шпат (самый распространенный минерал на Земле), цеолиты и ультрамарины . Многие полевые шпаты можно рассматривать как часть тройной системы NaAlSi 3 O 8 –KAlSi 3 O 8 –CaAl 2 Si 2 O 8 . Их решетка разрушается под действием высокого давления, в результате чего Al III претерпевает шестикоординированную, а не четырехкоординированную реакцию, и эта реакция, разрушающая полевые шпаты, может быть причиной разрыва Мохоровича , что означает, что кора и мантия имеют одинаковый химический состав, но различные решетки, хотя это не универсальная точка зрения. Цеолиты имеют много полиэдрических полостей в их каркасе ( усеченные кубооктаэдры являются наиболее распространенными, но другие многогранники также известны как полости цеолитов), что позволяет им включать в свою структуру слабосвязанные молекулы, такие как вода. Ультрамарины чередуют атомы кремния и алюминия и включают множество других анионов, таких как Cl - , SO.2-
4, а S2-
2, но в остальном похожи на полевые шпаты.
Другие неорганические соединения
Дисульфид кремния (SiS 2 ) образуется при сжигании кремния в газообразной сере при 100 ° C; сублимация полученного соединения в азоте приводит к образованию белых гибких длинных волокон, напоминающих асбест, со структурой, подобной W-диоксиду кремния. Он плавится при 1090 ° C и возгоняется при 1250 ° C; при высокой температуре и давлении он трансформируется в кристаллическую структуру, аналогичную кристобалиту. Однако SiS 2 не имеет разнообразных структур SiO 2 и быстро гидролизуется до кремнезема и сероводорода . Он также быстро и полностью аммонолизируется жидким аммиаком с образованием имида :
- SiS 2 + 4 NH 3 → Si (NH) 2 + 2 NH 4 SH
Он реагирует с сульфидами натрия, магния, алюминия и железа с образованием тиосиликатов металлов : реакция с этанолом приводит к тетраэтилсиликату Si (OEt) 4 и сероводороду. Этилсиликат полезен, поскольку при его контролируемом гидролизе образуются адгезивные или пленкообразные формы диоксида кремния. Взаимодействие сероводорода с тетрагалогенидами кремния дает тиогалогениды кремния, такие как S (SiCl) 3 , циклический Cl 2 Si (μ-S) 2 SiCl 2 и кристаллический (SiSCl 2 ) 4 . Несмотря на правило двойной связи , стабильные органосилантионы RR'Si = S были получены благодаря стабилизирующему механизму межмолекулярной координации через аминогруппу .
Нитрид кремния Si 3 N 4 может быть образован путем прямой реакции кремния с азотом при температуре выше 1300 ° C, но более экономичным способом производства является нагревание кремнезема и кокса в потоке азота и газообразного водорода при температуре 1500 ° C. Из нее получилась бы многообещающая керамика, если бы не сложность ее обработки и спекания: химически она практически полностью инертна и даже при температуре выше 1000 ° C сохраняет свою прочность, форму и устойчивость к износу и коррозии. Он очень твердый (9 по шкале твердости Мооса ), диссоциирует только при 1900 ° C при 1 атм и довольно плотный (плотность 3,185 г / см 3 ) из-за его компактной структуры, аналогичной структуре фенакита ( Be
2SiO
4). Аналогичным тугоплавким материалом является Si 2 N 2 O, образованный нагреванием кремния и диоксида кремния при 1450 ° C в потоке аргона, содержащем 5% газообразного азота, с участием 4-координатного кремния и 3-координатного азота, чередующихся в гексагональных гексагональных пластинах, связанных между собой не- линейные связи Si – O – Si друг с другом.
Взаимодействие силилгалогенидов с аммиаком или производными алкиламмония в газовой фазе или в этанольном растворе дает различные летучие силиламиды, которые являются кремниевыми аналогами аминов :
- 3 SiH 3 Cl + 4 NH 3 → N (SiH 3 ) 3 + 3 NH 4 Cl
- SiH 3 Br + 2 Me 2 NH → SiH 3 NMe 2 + Me 2 NH 2 Br
- 4 SiH 3 I + 5 N 2 H 4 → (SiH 3 ) 2 NN (SiH 3 ) 2 + 4 N 2 H 5 I
Было получено много таких соединений, единственное известное ограничение состоит в том, что азот всегда является третичным, а частицы, содержащие группу SiH – NH, нестабильны при комнатной температуре. Стехиометрия вокруг атома азота в соединениях, таких как N (SiH 3 ) 3 , плоская, что было приписано взаимодействию ap π –d π между неподеленной парой на азоте и пустой d π- орбиталью на кремнии. Точно так же трисилиламины являются более слабыми в качестве лигандов, чем их углеродные аналоги, третичные амины, хотя замещение некоторых групп SiH 3 группами CH 3 смягчает эту слабость. Например, N (SiH 3 ) 3 вообще не образует аддукта с BH 3 , в то время как MeN (SiH 3 ) 2 и Me 2 NSiH 3 образуют аддукты при низких температурах, которые разлагаются при нагревании. Известны некоторые кремниевые аналоги иминов с двойной связью Si = N: первым был обнаружен Bu t 2 Si = N – SiBu t 3 , открытый в 1986 году.
Карбид кремния (SiC) был впервые изготовлен Эдвардом Гудричем Ачесоном в 1891 году, который назвал его карборундом, чтобы указать на его промежуточную твердость и абразивную способность между алмазом (аллотроп углерода) и корундом ( оксид алюминия ). Вскоре он основал компанию по его производству, и сегодня ежегодно производится около миллиона тонн. Карбид кремния существует примерно в 250 кристаллических формах. Полиморфизм SiC характеризуется большим семейством подобных кристаллических структур, называемых политипами. Это разновидности одного и того же химического соединения, которые идентичны в двух измерениях и различаются в третьем. Таким образом, их можно рассматривать как слои, уложенные в определенной последовательности. Производится в промышленных масштабах восстановлением кварцевого песка с избытком кокса или антрацита при 2000–2500 ° C в электропечи:
- SiO 2 + 2 C → Si + 2 CO
- Si + C → SiC
Это наиболее термостойкое бинарное соединение кремния, разлагающееся только за счет потери кремния, начиная примерно с 2700 ° C. Он устойчив к большинству водных кислот, за исключением фосфорной кислоты . Он образует защитный слой из диоксида кремния на поверхности и, следовательно, значительно окисляется только на воздухе при температуре выше 1000 ° C; удаление этого слоя расплавленными гидроксидами или карбонатами приводит к быстрому окислению. Карбид кремния быстро разрушается газообразным хлором, который образует SiCl 4 и углерод при 100 ° C и SiCl 4 и CCl 4 при 1000 ° C. Он в основном используется как абразивный и огнеупорный материал, так как он химически стабилен и очень прочен, а также ломается, образуя очень острую режущую кромку. Он также полезен как собственный полупроводник, а также как внешний полупроводник после легирования. По своему алмазоподобному поведению он служит иллюстрацией химического сходства углерода и кремния.
Кремнийорганические соединения
Так как Si-C связь близка по прочности к связи С-С, кремнийорганические соединения , как правило, заметно термически и химически стабильными. Например, тетрафенилсилан (SiPh 4 ) можно перегонять на воздухе даже при его температуре кипения 428 ° C, как и его замещенные производные Ph 3 SiCl и Ph 2 SiCl 2 , которые кипят при 378 ° C и 305 ° C соответственно. Кроме того, поскольку углерод и кремний являются химическими конгенерами, кремнийорганическая химия демонстрирует некоторые существенные сходства с химией углерода, например, в склонности таких соединений к образованию цепей и множественных связей. Однако возникают и существенные различия: поскольку кремний более электроположителен, чем углерод, связи с большим количеством электроотрицательных элементов обычно сильнее с кремнием, чем с углеродом, и наоборот. Таким образом, связь Si – F значительно прочнее, чем даже связь C – F, и является одной из самых сильных одинарных связей, в то время как связь Si – H намного слабее, чем связь C – H, и легко разрывается. Кроме того, способность кремния расширять свой октет не разделяется углеродом, и, следовательно, некоторые кремнийорганические реакции не имеют органических аналогов. Например, нуклеофильная атака на кремний не осуществляется процессами S N 2 или S N 1 , а вместо этого проходит через отрицательно заряженный истинный пентакоординированный промежуточный продукт и проявляется как замещение у затрудненного третичного атома. Это работает для кремния, в отличие от углерода, потому что длинные связи Si – C уменьшают стерические препятствия, а d-орбиталь кремния геометрически не ограничена для нуклеофильной атаки, в отличие, например, от антисвязывающей орбитали C – O σ *. Тем не менее, несмотря на эти различия, механизм по-прежнему часто называют «S N 2 на кремнии» для простоты.
Одной из наиболее полезных кремнийсодержащих групп является триметилсилил Me 3 Si–. Связь Si – C, соединяющая его с остальной частью молекулы, достаточно прочна, что позволяет ей оставаться, пока остальная часть молекулы претерпевает реакции, но не настолько сильна, чтобы ее нельзя было удалить, когда это необходимо, например, с помощью фторид- иона. , который является очень слабым нуклеофилом для углеродных соединений, но очень сильным для кремнийорганических соединений. Его можно сравнить с кислотными протонами ; в то время как трисилилметил удаляется твердыми нуклеофилами вместо оснований, оба удаления обычно способствуют удалению. Как правило, в то время как насыщенный углерод лучше всего атакуется нуклеофилами, которые являются нейтральными соединениями, соединениями, основанными на неметаллах, находящихся далеко внизу периодической таблицы (например, сера, селен или йод ), или даже обоими, кремний лучше всего атакуется заряженными нуклеофилами, особенно те, которые включают такие сильно электроотрицательные неметаллы, как кислород, фтор или хлор. Например, еноляты реагируют с углеродом в галогеналканах , но с кислородом в силилхлоридах ; и когда триметилсилил удаляется из органической молекулы с использованием гидроксида в качестве нуклеофила, продуктом реакции не является силанол, как можно было бы ожидать, используя химию углерода в качестве аналогии, потому что силоксид является сильно нуклеофильным и атакует исходную молекулу, давая силиловый эфир гексаметилдисилоксан , (Me 3 Si) 2 O. И наоборот, хотя на реакцию S N 2 в основном не влияет наличие частичного положительного заряда (δ +) у углерода, аналогичная реакция «S N 2» на кремнии протекает. так подействовало. Таким образом, например, силильные трифлаты настолько электрофильные , что они реагируют 10 8 до 10 9 раз быстрее , чем силильные хлориды с кислородсодержащими нуклеофилами. Триметилсилилтрифлат является, в частности, очень хорошей кислотой Льюиса и используется для превращения карбонильных соединений в ацетали и простые эфиры силиленола , взаимодействуя между собой аналогично альдольной реакции .
Связи Si – C обычно образуются тремя способами. В лаборатории, подготовка часто проводится в небольших количествах путем взаимодействия тетрахлорсиланом (тетрахлорид кремния) с литийорганическим , Гриньяра или алюминийорганических реагентов, либо путем каталитического добавления Si-H через С = С двойных связей. Недостатком второго пути является то, что он неприменим к наиболее важным силанам, метил- и фенилсиланам. Органосиланы производятся в промышленных масштабах путем прямого взаимодействия алкил- или арилгалогенидов с кремнием с 10 мас.% Металлической меди в качестве катализатора. Стандартных органических реакций достаточно для получения многих производных; полученные органосиланы часто значительно более реакционноспособны, чем их углеродные родственные соединения, легко подвергаются гидролизу, аммонолизу, алкоголизу и конденсации с образованием циклических олигомеров или линейных полимеров.
Силиконовые полимеры

Слово «силикон» впервые использовал Фредерик Киппинг в 1901 году. Он изобрел это слово, чтобы проиллюстрировать сходство химических формул между Ph 2 SiO и бензофеноном , Ph 2 CO, хотя он также подчеркнул отсутствие химического сходства из-за полимерной структуры. Ph 2 SiO, который не разделяется с Ph 2 CO.
Силиконы можно рассматривать как аналог минеральных силикатов, в которых метильные группы силиконов соответствуют изоэлектронным О - силикатов. Они довольно устойчивы к экстремальным температурам, окислению и воздействию воды, а также обладают полезными диэлектрическими, антипригарными и противопенными свойствами. Кроме того, они устойчивы в течение длительного времени к ультрафиолетовому излучению и атмосферным воздействиям, а также физиологически инертны. Они довольно инертны, но реагируют с концентрированными растворами, содержащими гидроксид-ион и фторирующие агенты, а иногда даже могут использоваться в качестве мягких реагентов для селективного синтеза. Например, (Me 3 Si) 2 O ценен для получения производных оксигалогенидов молибдена и вольфрама , количественно превращая суспензию гексахлорида вольфрама в растворе дихлорэтана в WOCl 4 менее чем за час при комнатной температуре, а затем в желтый WO 2 Cl. 2 при 100 ° C в легком бензине с выходом 95% в течение ночи.
Вхождение
Кремний является восьмым по распространенности элементом во Вселенной после водорода , гелия , углерода , азота , кислорода , железа и неона . Это количество плохо воспроизводится на Земле из-за значительного разделения элементов, происходящего во время формирования Солнечной системы . Кремний составляет 27,2% по весу земной коры, уступая только кислороду с 45,5%, с которым он всегда связан в природе. Дальнейшее фракционирование происходило при формировании Земли путем планетарной дифференциации : ядро Земли , составляющее 31,5% массы Земли, имеет примерный состав Fe 25 Ni 2 Co 0,1 S 3 ; мантии составляет 68,1% от массы Земли и состоит в основном из оксидов более плотных и силикатов, примером чего является оливин , (Mg, Fe) 2 SiO 4 ; в то время как более легкие кремнистые минералы, такие как алюмосиликаты, поднимаются на поверхность и образуют кору, составляющую 0,4% массы Земли.
Кристаллизация магматических пород из магмы зависит от ряда факторов; Среди них химический состав магмы, скорость охлаждения и некоторые свойства отдельных минералов, которые должны быть сформированы, такие как энергия решетки , температура плавления и сложность их кристаллической структуры. По мере охлаждения магмы сначала появляется оливин , затем пироксен , амфибол , биотитовая слюда, ортоклазовый полевой шпат , мусковитовая слюда , кварц , цеолиты и, наконец, гидротермальные минералы. Эта последовательность показывает тенденцию к усложнению силикатных единиц с охлаждением и введением гидроксидных и фторид- анионов в дополнение к оксидам. Многие металлы могут заменять кремний. После того, как эти магматические породы подвергаются выветриванию , переносу и отложению, образуются осадочные породы, такие как глина, сланец и песчаник. Метаморфизм также может происходить при высоких температурах и давлениях, создавая еще более обширное разнообразие минералов.
Есть четыре источника потоков кремния в океан, включая химическое выветривание континентальных горных пород, речной перенос, растворение континентальных терригенных силикатов и реакцию между подводными базальтами и гидротермальным флюидом, которые высвобождают растворенный кремний. Все четыре потока взаимосвязаны в биогеохимическом цикле океана, поскольку все они изначально образовались в результате выветривания земной коры.
Ежегодно в Мировой океан попадает примерно 300-900 мегатонн эоловой пыли. Из этой суммы 80–240 мегатонн находятся в форме твердых частиц кремния. Общее количество осаждения кремния в виде твердых частиц в океан по-прежнему меньше, чем количество кремния, поступающего в океан речным транспортом. Эолийские поступления литогенного кремния в виде частиц в североатлантический и западный районы северной части Тихого океана являются результатом оседания пыли в океанах из Сахары и пустыни Гоби, соответственно. Речной транспорт является основным источником поступления кремния в океан в прибрежных регионах, в то время как отложение кремния в открытом океане сильно зависит от осаждения эолийской пыли.
Производство
Кремний чистотой 96–99% получают восстановлением кварцита или песка высокочистым коксом . Восстановление осуществляется в электродуговой печи с использованием избытка SiO 2 для предотвращения накопления карбида кремния (SiC):
- SiO 2 + 2 C → Si + 2 CO
- 2 SiC + SiO 2 → 3 Si + 2 CO
Эта реакция, известная как карботермическое восстановление диоксида кремния, обычно проводится в присутствии железного лома с низким содержанием фосфора и серы с образованием ферросилиция . Ферросилиций, железо-кремниевый сплав, содержащий различные соотношения элементарного кремния и железа, составляет около 80% мирового производства элементарного кремния, при этом Китай, лидирующий поставщик элементарного кремния, обеспечивает 4,6 миллиона тонн (или 2/3 производства). мировой объем производства) кремния, в основном в виде ферросилиция. Далее следуют Россия (610 000 т), Норвегия (330 000 т), Бразилия (240 000 т) и США (170 000 т). Ферросилиций в основном используется в черной металлургии (см. Ниже ) в качестве легирующей добавки в чугун или сталь и для деокисления стали на металлургических заводах.
Другой реакцией, которая иногда используется, является алюминотермическое восстановление диоксида кремния, а именно:
- 3 SiO 2 + 4 Al → 3 Si + 2 Al 2 O 3
Выщелачивание порошкообразного кремния с чистотой 96–97% водой приводит к получению кремния с чистотой ~ 98,5%, который используется в химической промышленности. Однако для полупроводниковых применений требуется еще большая чистота, и ее получают за счет восстановления тетрахлорсилана (тетрахлорида кремния) или трихлорсилана . Первые получают путем хлорирования лома кремния, а вторые являются побочным продуктом производства силикона . Эти соединения летучие и, следовательно, могут быть очищены повторной фракционной перегонкой с последующим восстановлением до элементарного кремния с очень чистым металлическим цинком в качестве восстановителя. Полученные таким образом губчатые куски кремния расплавляют и затем выращивают с образованием цилиндрических монокристаллов перед очисткой зонной очисткой . Другие способы используют термическое разложение силана или тетраиодосилана ( SiI
4). Другой используемый процесс - восстановление гексафторсиликата натрия , обычного отхода производства фосфатных удобрений, металлическим натрием : это сильно экзотермический процесс и, следовательно, не требует внешнего источника топлива.
Сверхтонкий кремний производится с более высокой чистотой, чем почти любой другой материал: для производства транзисторов требуются уровни примесей в кристаллах кремния менее 1 части на 10 10 , а в особых случаях уровни примесей ниже 1 части на 10 12 необходимы и достигаются.
Приложения
Соединения
Большая часть кремния используется в промышленности без очистки и, действительно, часто с относительно небольшой обработкой его естественной формы. Более 90% земной коры состоит из силикатных минералов , которые представляют собой соединения кремния и кислорода, часто с ионами металлов, когда отрицательно заряженным силикатным анионам требуются катионы для балансировки заряда. Многие из них имеют прямое коммерческое использование, например, глины, кварцевый песок и большинство видов строительного камня. Таким образом, в подавляющем большинстве случаев кремний используется в качестве структурных соединений, например, силикатных минералов или кремнезема (неочищенный диоксид кремния). Силикаты используются для изготовления портландцемента (в основном из силикатов кальция), который используется в строительном растворе и современной штукатурке , но, что более важно, в сочетании с кварцевым песком и гравием (обычно содержащим силикатные минералы, такие как гранит), чтобы сделать бетон, который является основой большинства крупнейших промышленных строительных проектов современного мира.
Кремнезем используется для изготовления огнеупорного кирпича , разновидности керамики. Силикатные минералы также входят в состав белой керамики , важного класса продуктов, обычно содержащих различные типы минералов обожженной глины (природные филлосиликаты алюминия). Примером может служить фарфор на основе силикатного минерала каолинита . Традиционное стекло ( натриево-кальциевое стекло на основе диоксида кремния ) также действует во многом аналогичным образом, а также используется для изготовления окон и контейнеров. Кроме того, специальные стекловолокна на основе диоксида кремния используются для изготовления оптических волокон , а также для производства стекловолокна для структурной опоры и стекловаты для теплоизоляции.
Силиконы часто используются в гидроизоляции процедуры, формованием соединения, mold- агенты высвобождения , механические уплотнения, высокотемпературные смазки и воски, и чеканки соединений. Силикон также иногда используется в грудных имплантатах , контактных линзах, взрывчатых веществах и пиротехнике . Первоначально Silly Putty была изготовлена путем добавления борной кислоты в силиконовое масло . Другие соединения кремния действуют как высокотехнологичные абразивы и новая высокопрочная керамика на основе карбида кремния . Кремний входит в состав некоторых суперсплавов .
Сплавы
Элементарный кремний добавляют в расплавленный чугун в виде ферросилициевых или силикокальциевых сплавов для улучшения характеристик при литье тонких профилей и предотвращения образования цементита при контакте с внешним воздухом. Присутствие элементарного кремния в расплавленном чугуне действует как поглотитель кислорода, так что содержание углерода в стали, которое должно поддерживаться в узких пределах для каждого типа стали, можно более тщательно контролировать. Производство и использование ферросилиция контролирует сталелитейную промышленность, и, хотя эта форма элементарного кремния крайне загрязнена, на нее приходится 80% мирового потребления свободного кремния. Кремний - важный компонент электротехнической стали , изменяющий ее удельное сопротивление и ферромагнитные свойства.
Свойства кремния можно использовать для модификации сплавов с металлами, отличными от железа. Кремний «Металлургический» - это кремний чистотой 95–99%. Около 55% мирового потребления кремния металлургической чистоты идет на производство алюминиево-кремниевых сплавов ( силуминовых сплавов) для литья алюминиевых деталей , в основном для использования в автомобильной промышленности . Важность кремния в алюминиевом литье заключается в том, что значительное количество (12%) кремния в алюминии образует эвтектическую смесь, которая затвердевает с очень небольшим тепловым сжатием. Это значительно снижает разрыв и трещины, возникающие из-за напряжения, когда литейные сплавы остывают до твердости. Кремний также значительно улучшает твердость и, следовательно, износостойкость алюминия.
Электроника
Большая часть производимого элементарного кремния остается в виде сплава ферросилиция, и только около 20% очищается до металлургической чистоты (всего 1,3–1,5 миллиона метрических тонн в год). По оценкам, 15% мирового производства кремния металлургического качества перерабатывается до полупроводниковой чистоты. Обычно это практически бездефектный монокристаллический материал с чистотой «девять-9» или 99,9999999% .
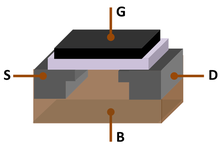
Монокристаллический кремний такой чистоты обычно производится с помощью процесса Чохральского , который используется для производства кремниевых пластин, используемых в полупроводниковой промышленности , в электронике и в некоторых дорогостоящих и высокоэффективных фотоэлектрических устройствах. Чистый кремний является внутренним полупроводником , а это означает, что в отличие от металлов он проводит электронные дырки и электроны, высвобождаемые из атомов под действием тепла; Электропроводность кремния увеличивается с повышением температуры. Чистый кремний имеет слишком низкую проводимость (т. Е. Слишком высокое удельное сопротивление ), чтобы его можно было использовать в качестве элемента схемы в электронике. На практике чистый кремний легирован небольшими концентрациями некоторых других элементов, которые значительно увеличивают его проводимость и регулируют его электрический отклик, контролируя количество и заряд ( положительный или отрицательный ) активированных носителей. Такой контроль необходим для транзисторов , солнечных элементов , полупроводниковых детекторов и других полупроводниковых устройств, используемых в компьютерной промышленности и других технических приложениях. В кремниевой фотонике кремний может использоваться как среда непрерывного рамановского лазера для получения когерентного света.
В обычных интегральных схемах пластина из монокристаллического кремния служит механической опорой для схем, которые создаются путем легирования и изолированы друг от друга тонкими слоями оксида кремния , изолятора, который легко наносится на поверхности Si с помощью процессов термического окисления. или локальное окисление (LOCOS) , при котором элемент подвергается воздействию кислорода в надлежащих условиях, которые можно предсказать с помощью модели Дила – Гроува . Кремний стал самым популярным материалом как для мощных полупроводников, так и для интегральных схем, поскольку он может выдерживать самые высокие температуры и наибольшую электрическую активность, не подвергаясь лавинообразному пробою ( электронная лавина создается, когда тепло производит свободные электроны и дырки, которые, в свою очередь, пропускают больше тока , который производит больше тепла). Кроме того, изолирующий оксид кремния не растворяется в воде, что дает ему преимущество перед германием (элементом с аналогичными свойствами, который также может использоваться в полупроводниковых устройствах) в определенных технологиях изготовления.
Монокристаллический кремний дорог в производстве и обычно оправдан только при производстве интегральных схем, где крошечные дефекты кристалла могут мешать прохождению крошечных цепей. Для других целей можно использовать другие типы чистого кремния. К ним относятся гидрогенизированный аморфный кремний и модернизированный кремний металлургического сорта (UMG-Si), используемый в производстве недорогой электроники большой площади в таких приложениях, как жидкокристаллические дисплеи и недорогие тонкопленочные солнечные батареи большой площади. клетки . Такие полупроводниковые марки кремния либо немного менее чистые, либо поликристаллические, а не монокристаллические, и производятся в сопоставимых количествах с монокристаллическим кремнием: от 75 000 до 150 000 метрических тонн в год. Рынок меньшего сорта кремния растет быстрее, чем монокристаллический кремний. К 2013 году производство поликристаллического кремния, используемого в основном в солнечных элементах, по прогнозам, достигнет 200 000 метрических тонн в год, в то время как производство монокристаллического кремния полупроводникового качества останется на уровне менее 50 000 тонн в год.
Квантовые точки
Кремниевые квантовые точки создаются путем термической обработки водородного силсесквиоксана в нанокристаллы размером от нескольких нанометров до нескольких микрон, демонстрируя люминесцентные свойства, зависящие от размера . Нанокристаллы демонстрируют большие стоксовы сдвиги, преобразующие фотоны ультрафиолетового диапазона в фотоны видимого или инфракрасного диапазона, в зависимости от размера частиц, что позволяет использовать их в дисплеях с квантовыми точками и люминесцентных концентраторах солнечного излучения из-за их ограниченного самопоглощения. Преимущество использования квантовых точек на основе кремния по сравнению с кадмием или индием заключается в том, что кремний не токсичен и не содержит металлов. Еще одно применение кремниевых квантовых точек - обнаружение опасных материалов. Датчики используют люминесцентные свойства квантовых точек за счет гашения фотолюминесценции в присутствии опасного вещества. Существует множество методов, используемых для обнаружения опасных химических веществ, некоторые из которых включают перенос электронов, резонансный перенос энергии флуоресценции и генерацию фототока. Тушение переноса электронов происходит, когда нижняя незанятая молекулярная орбиталь (НСМО) немного ниже по энергии, чем зона проводимости квантовой точки, что позволяет переносить электроны между ними, предотвращая рекомбинацию дырок и электронов внутри нанокристаллов. Эффект также может быть достигнут в обратном направлении, если у донорной молекулы самая высокая занятая молекулярная орбиталь (ВЗМО) немного выше края валентной зоны квантовой точки, что позволяет электронам перемещаться между ними, заполняя дырки и предотвращая рекомбинацию. Флуоресцентный резонансный перенос энергии происходит, когда между квантовой точкой и молекулой тушителя образуется комплекс. Комплекс будет продолжать поглощать свет, но когда энергия преобразуется в основное состояние, он не испускает фотон, гася материал. Третий метод использует другой подход, измеряя фототок, излучаемый квантовыми точками, вместо наблюдения за фотолюминесцентным дисплеем. Если концентрация желаемого химического вещества увеличивается, то фототок, излучаемый нанокристаллами, в ответ изменится.
Биологическая роль
Хотя кремний легко доступен в виде силикатов , очень немногие организмы используют его напрямую. Диатомовые водоросли , радиолярии и кремнистые губки используют биогенный кремнезем в качестве структурного материала для своих скелетов. У более развитых растений фитолиты кремнезема ( фитолиты опала) представляют собой твердые микроскопические тела, встречающиеся в клетке; некоторым растениям, например, рису , для роста нужен кремний. Было показано, что кремний улучшает прочность стенок растительных клеток и структурную целостность некоторых растений.
Известно, что некоторые садовые культуры защищают себя кремнием от грибковых патогенов растений до такой степени, что применение фунгицидов может быть неудачным, если они не сопровождаются достаточным питанием кремнием. Защитные молекулы кремнеземных растений активируют некоторые фитоалексины , что означает, что некоторые из них являются сигнальными веществами, обеспечивающими приобретенный иммунитет . При недостатке некоторые растения заменяют их повышенным производством других защитных веществ.
Влияние морских микробов
В диатомовых водорослях кремний используется в форме биогенного кремнезема (BSIO 2 ), который поглощается транспортным белком кремния (SIT), который преимущественно используется в структуре клеточной стенки в виде панцирей. Кремний попадает в океан в растворенном виде, например, в кремниевой кислоте или силикате. Поскольку диатомовые водоросли являются одними из основных пользователей этих форм кремния, они вносят большой вклад в концентрацию кремния по всему океану. Кремний образует в океане профиль питательных веществ из-за продуктивности диатомовых водорослей на небольших глубинах. Следовательно, меньшая концентрация кремния в верхних слоях океана и большая концентрация кремния в глубоких / нижних слоях океана.
Продуктивность диатомовых водорослей в верхних слоях океана способствует увеличению количества кремния, экспортируемого в нижние слои океана. Когда клетки диатомовых водорослей лизируются в верхних слоях океана, их питательные вещества, такие как железо, цинк и кремний, попадают в нижние слои океана посредством процесса, называемого морским снегом. Морской снег предполагает перенос вниз твердых органических веществ за счет вертикального перемешивания растворенных органических веществ. Было высказано предположение, что кремний имеет решающее значение для продуктивности диатомовых водорослей, и до тех пор, пока диатомовые водоросли могут использовать кремниевую кислоту, диатомеи могут вносить вклад в другие важные концентрации питательных веществ в глубинах океана.
В прибрежных зонах диатомовые водоросли служат основными фитопланктонными организмами и вносят большой вклад в производство биогенного кремнезема. Однако в открытом океане роль диатомовых водорослей в годовом мировом производстве кремнезема снижается. На диатомовые водоросли в субтропических круговоротах Северной Атлантики и Северной части Тихого океана приходится лишь около 5-7% мирового годового производства кремнезема. Южный океан производит около одной трети мирового морского биогенного кремнезема. Южный океан считается «биогеохимическим водоразделом», поскольку из этого региона транспортируется лишь мизерное количество кремния.
Питание человека
Есть некоторые свидетельства того, что кремний важен для здоровья человека для его ногтей, волос, костей и кожных тканей, например, в исследованиях, которые демонстрируют, что женщины в пременопаузе с повышенным потреблением кремния в рационе имеют более высокую плотность костной ткани , и что добавки кремния могут увеличить костную ткань. объем и плотность у больных остеопорозом . Кремний необходим для синтеза эластина и коллагена , из которых аорта содержит наибольшее количество в организме человека и считается важным элементом ; тем не менее, трудно доказать его важность, потому что кремний очень распространен, и, следовательно, трудно воспроизвести симптомы дефицита.
Кремний в настоящее время рассматривается Ассоциацией американских чиновников по контролю за продуктами питания (AAPFCO), чтобы повысить его статус «полезного для растений вещества».
Безопасность
Люди могут подвергнуться воздействию элементарного кремния на рабочем месте, вдыхая его, глотая или контактируя с кожей или глазами. В последних двух случаях кремний представляет небольшую опасность в качестве раздражителя. Опасно при вдыхании. Управление по безопасности и гигиене труда (OSHA) установило допустимый предел воздействия кремния на рабочем месте: общее воздействие 15 мг / м 3 и воздействие дыхательных путей 5 мг / м 3 в течение восьмичасового рабочего дня. Национальный институт профессиональной безопасности и здоровья (NIOSH) установила предел рекомендуемой экспозиции (REL) от 10 мг / м 3 общей экспозиции и 5 мг / м 3 дыхательного воздействия в течение восьмичасового рабочего дня. Вдыхание пыли кристаллического кремнезема может привести к силикозу , профессиональному заболеванию легких, характеризующемуся воспалением и рубцеванием в виде узловых поражений в верхних долях легких .
Смотрите также
- Аморфный кремний
- Черный кремний
- Ковалентные сверхпроводники
- Список стран по производству кремния
- Список производителей кремния
- Монокристаллический кремний
- Кремниевые нанопроволоки (SiNW)
- Поликристаллический кремний
- Печатная силиконовая электроника
- Кремний томбак
- Силиконовая Долина
- Кремниевый Вади
- Транзистор
использованная литература
Библиография
- Клейден, Джонатан ; Гривс, Ник; Уоррен, Стюарт (2012). Органическая химия (2-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-927029-3.
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- Кинг, Р. Брюс (1995). Неорганическая химия элементов основных групп . Wiley-VCH. ISBN 978-0-471-18602-1.
- Зуленер, Вернер; Нойер, Бернд; Рау, Герхард. «Кремний». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a23_721 .
внешние ссылки
- «Кремниевое видео - Периодическая таблица видео - Ноттингемский университет» . www.periodicvideos.com . Проверено 8 июня 2021 .
- «CDC - Карманный справочник NIOSH по химическим опасностям - кремний» . www.cdc.gov . Проверено 8 июня 2021 .
- «Физические свойства кремния (Si)» . www.ioffe.ru . Проверено 8 июня 2021 .