Гексахлорфосфазен - Hexachlorophosphazene
|
|

|
|
| Имена | |
|---|---|
|
Название ИЮПАК
2,2,4,4,6,6-гексахлор-1,3,5,2λ 5 , 4λ 5 , 6λ 5 -триазатрифосфинин
|
|
| Другие имена
Phosphonitrilic тример хлорида
Hexachlorotriphosphazene Hexachlorocyclotriphosphazene Triphosphonitrilic хлорид 2,2,4,4,6,6-гексахлор-2,2,4,4,6,6- гексагидро-1,3,5,2,4,6-triazatriphosphorine |
|
| Идентификаторы | |
|
3D модель ( JSmol )
|
|
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard |
100.012.160 |
| Номер ЕС | |
|
PubChem CID
|
|
| UNII | |
|
Панель управления CompTox ( EPA )
|
|
|
|
|
|
| Характеристики | |
| N 3 Cl 6 P 3 | |
| Молярная масса | 347,66 г / моль |
| Появление | бесцветное твердое вещество |
| Плотность | 1,98 г / мл при 25 ° C |
| Температура плавления | От 112 до 114 ° C (от 234 до 237 ° F, от 385 до 387 K) |
| Точка кипения | разлагается (выше 167 ° C) |
| 60 ° C при 0,05 торр | |
| разлагается | |
| Растворимость в CCl4 | 24,5 мас.% (20 ° C) 35,6 мас.% (40 ° C) 39,2 мас.% (60 ° C) |
| Растворимость в циклогексане | 22,3 мас.% (20 ° C) 36,8 мас.% (40 ° C) 53,7 мас.% (60 ° C) |
| Растворимость в ксилоле | 27,7 мас.% (20 ° C) 38,9 мас.% (40 ° C) 50,7 мас.% (60 ° C) |
| -149 × 10 −6 см 3 · моль −1 | |
|
Показатель преломления ( n D )
|
1,62 (589 нм) |
| Состав | |
| ромбический | |
| 62 (Пнма, Д16 2ч) |
|
| Д 3ч | |
|
a = 13,87 Å, b = 12,83 Å, c = 6,09 Å
|
|
|
Формула единиц ( Z )
|
4 |
| стул (слегка взъерошенный) | |
| 0 Д | |
| Термохимия | |
|
Std энтальпия
формации (Δ F H ⦵ 298 ) |
-812,4 кДж · моль -1 |
|
Энтальпия парообразования (Δ f H vap )
|
55,2 кДж · моль -1 |
|
Энтальпия сублимации (Δ f H sublim )
|
76,2 кДж · моль -1 |
| Опасности | |
| Основные опасности | мягкий раздражитель |
| Пиктограммы GHS |

|
| Сигнальное слово GHS | Опасность |
| H314 | |
| Р260 , Р264 , Р280 , Р301 + 330 + 331 , P303 + 361 + 353 , Р304 + 340 , P305 + 351 + 338 , P310 , P321 , P363 , P405 , P501 | |
| точка возгорания | Не воспламеняется |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
Гексахлорфосфазен представляет собой неорганическое соединение с формулой (NPCl 2 ) 3 . Молекула имеет циклический ненасыщенный скелет, состоящий из чередующихся центров фосфора и азота , и может рассматриваться как тример гипотетического соединения N≡PCl 2 . Его классификация как фосфазена подчеркивает его связь с бензолом. Соединение представляет большой академический интерес, связанный с фосфорно-азотной связью и реакционной способностью фосфора.
Иногда также сообщалось о коммерческих или предлагаемых практических применениях с использованием гексахлорфосфазена в качестве химического вещества-предшественника. Производные, представляющие отмеченный интерес, включают гексалкоксифосфазеновые смазывающие вещества, полученные путем нуклеофильного замещения гексахлорфосфазена алкоксидами , или химически стойкие неорганические полимеры с желательными термическими и механическими свойствами, известные как полифосфазены, полученные в результате полимеризации гексахлорфосфазена.
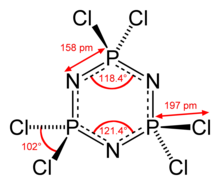
Структура и характеристика
Длина и структура связи
Гексахлорфосфазен имеет ядро P 3 N 3 с шестью эквивалентными связями P – N, для которых соседние расстояния P – N составляют 157 пм. Это характерно короче ок . Связи P – N 177 пм в валентно-насыщенных аналогах фосфазана .
Молекула обладает симметрией D 3h , и каждый фосфорный центр тетраэдрический с углом Cl – P – Cl 101 °.
Кольцо P 3 N 3 в гексахлорфосфазене отклоняется от планарности и слегка взъерошено (см. Конформацию стула ). Напротив, кольцо P 3 N 3 в родственных разновидностях гексафторфосфазена является полностью плоским.
Методы характеризации
Спектроскопия ЯМР 31 P - обычный метод определения гексахлорфосфазина и его реакций. Гексахлорфосфазин проявляет единственный резонанс при 20,6 ppm, поскольку все среды P химически эквивалентны.
В его ИК-спектре колебательные полосы 1370 и 1218 см −1 отнесены к ν P − N- участкам. Другие полосы обнаруживаются при 860 и 500–600 см –1 , соответственно, относящиеся к кольцу и ν P – Cl .
Гексахлорфосфазин и многие его производные охарактеризованы методом рентгеновской кристаллографии монокристаллов .
Склеивание

Ранние анализы
Циклофосфазены, такие как гексахлорфосфазен, отличаются заметной стабильностью и одинаковой длиной связи PN, что во многих таких циклических молекулах может означать делокализацию или даже ароматичность. Чтобы учесть эти особенности, ранние модели связывания, начиная с середины 1950-х годов, использовали делокализованную π-систему, возникающую в результате перекрытия N 2 p и P 3 d орбиталей .
Современные склеивающие модели
Начиная с конца 1980-х годов более современные расчеты и отсутствие спектроскопических данных показывают, что вклад P 3 d незначителен, что опровергает более раннюю гипотезу. Вместо этого обычно принимается модель с разделением зарядов.
Согласно этому описанию связь P – N рассматривается как очень поляризованная (между условными P + и N - ) с достаточным ионным характером, чтобы составлять большую часть прочности связи.
Оставшаяся часть (~ 15%) прочности связи может быть отнесена к отрицательному сверхсопряженному взаимодействию: N неподеленных пар могут отдавать некоторую электронную плотность на π-принимающие σ * молекулярные орбитали на P.
Синтез
О синтезе гексахлорфосфазена впервые сообщил фон Либих в 1834 году. В этом отчете он описывает эксперименты, проведенные с Велером . Они обнаружили, что пентахлорид фосфора и аммиак экзотермически реагируют с образованием нового вещества, которое можно промыть холодной водой для удаления побочного продукта хлорида аммония . Новое соединение содержало P, N и Cl на основе элементного анализа . Он был чувствителен к гидролизу горячей водой.
Современные синтезы основаны на разработках Шенка и Ремера, которые использовали хлорид аммония вместо аммиака и инертных хлорированных растворителей. Замена аммиака хлоридом аммония позволяет реакции протекать без сильного экзотерма, связанного с реакцией NH 3 / PCl 5 . Типичными хлороуглеродными растворителями являются 1,1,2,2-тетрахлорэтан или хлорбензол , которые переносят побочный продукт хлористого водорода. Поскольку хлорид аммония нерастворим в хлорированных растворителях, обработка облегчается. Для реакции в таких условиях применяется следующая стехиометрия:
- NH 4 Cl + PCl 5 → 1 / n (NPCl 2 ) n + HCl
где n обычно может принимать значения n = 2 (димер тетрахлордифосфазен ), n = 3 (тример гексахлортрифосфазен) и n = 4 (тетрамер октахлортетрафосфазен ).
Очистка сублимацией дает в основном тример и тетрамер . Медленная сублимация в вакууме приблизительно при 60 ° C дает чистый тример, свободный от тетрамера. Условия реакции, такие как температура, также могут быть отрегулированы для максимального увеличения выхода тримера за счет других возможных продуктов; тем не менее коммерческие образцы гексахлорфосфазена обычно содержат заметные количества октахлортетрафосфазена, даже до 40%.
Механизм формирования
Механизм вышеуказанной реакции не был выяснен, но было высказано предположение, что PCl 5 находится в его ионной форме [PCl 4 ] + [PCl6] - и реакция протекает через нуклеофильную атаку PCl 4 + NH 3 (из Диссоциация NH 4 Cl). Удаление HCl (основного побочного продукта) создает реактивный нуклеофильный промежуточный продукт.
- NH 3 + PCl 4 + → «HN = PCl 3 » + HCl
который за счет дальнейшей атаки PCl 4 + и устранение последующего HCl, создает большую ациклическое промежуточный
- HN = PCl 3 + PCl 4 + → [Cl 3 P – N = PCl 3 ] + + HCl
- NH 3 + [Cl 3 P – N = PCl 3 ] + → [HN = P (Cl 2 ) –N = PCl 3 ] + + HCl и т. Д.
до тех пор, пока возможная внутримолекулярная атака не приведет к образованию одного из циклических олигомеров.
Реакции
Замена на P
Гексахлорфосфазен легко реагирует с алкоксидами и амидами щелочных металлов .
Nucelophilic polysubstitution хлорида по алкоксидам протекают через перемещение хлорида в отдельных фосфорных центрах:
- (NPCl 2 ) 3 + 3 NaOR → (NPCl (OR)) 3 + 3 NaCl
- (NPCl (OR)) 3 + 3 NaOR → (NP (OR) 2 ) 3 + 3 NaCl
Наблюдаемая региоселективность обусловлена комбинированными стерическими эффектами и π-бэкдонированием неподеленной пары кислорода (которое дезактивирует уже замещенные атомы P).
Полимеризация с раскрытием кольца
Нагревание гексахлорфосфазена до прибл . 250 ° C вызывает полимеризацию. Тетрамер также полимеризуется таким образом, хотя и медленнее. Конверсия представляет собой тип полимеризации с раскрытием кольца (ROP). Было обнаружено, что механизм ROP катализируется кислотами Льюиса , но в целом он не очень хорошо изучен. Продолжительное нагревание полимера при более высоких температурах ( около 350 ° C) вызовет деполимеризацию .
Структура неорганического хлорполимерного продукта ( полидихлорфосфазена ) включает линейную n- цепь (PNCl 2 ) , где n ~ 15000. Впервые это было обнаружено в конце 19 века, и его форма после сшивания цепи была названа «неорганическим каучуком» из-за его эластомерным свойствам.
Этот полидихлорфосфазеновый продукт является исходным материалом для широкого класса полимерных соединений, известных под общим названием полифосфазены . Замена хлоридных групп другими нуклеофильными группами, особенно алкоксидами, как изложено выше, дает многочисленные охарактеризованные производные.
Основность Льюиса
Азотные центры гексахлорфосфазена слабоосновные, и предполагалось, что это поведение основания Льюиса играет роль в механизме полимеризации. В частности, сообщалось, что гексахлорфосфазен образует аддукты различной стехиометрии с кислотами Льюиса AlCl 3 , AlBr 3 , GaCl 3 , SO 3 , TaCl 5 , VOCl 3 , но не выделяемый продукт с BCl 3 .
Среди них лучше всего структурно охарактеризованы аддукты 1: 1 с трихлоридом алюминия или с трихлоридом галлия; они обнаруживаются с атомом Al / Ga, связанным с N, и принимают более заметно искаженную конформацию кресла по сравнению со свободным гексахлорфосфазеном. Аддукты также демонстрируют текучесть в растворе при температурах до -60 ° C, что можно контролировать с помощью 15 N и 31 P ЯМР .
Связывающий реагент
Гексахлорфосфазен также нашел применение в исследованиях, позволяя проводить реакции ароматического сочетания между пиридином и N, N -диалкиланилинами или индолом , в результате чего образуются 4,4'-замещенные производные фенилпиридина , которые, как предполагается, проходят через промежуточное соединение соли циклофосфазена и пиридиния.
Соединение также можно использовать в качестве реагента пептидного сочетания для синтеза олигопептидов в хлороформе, хотя для этого применения тетрамер октахлортетрафосфазен обычно оказывается более эффективным.
Фотохимическая деградация
И тример, и тетрамер в углеводородных растворах фотохимически реагируют с образованием прозрачных жидкостей, идентифицированных как алкилзамещенные производные (NPCl 2− x R x ) n = 3,4 . Такие реакции протекают при длительном облучении УФС ( ртутной дугой ), не затрагивая кольца P n N n . Твердые пленки тримера и тетрамера не претерпевают никаких химических изменений в таких условиях облучения.
Приложения
Производные гексалкоксифосфазена
Гексалкоксифосфазены (особенно арилокси- разновидности), образующиеся в результате нуклеофильного гексазамещения атомов P гексахлорфосфазена, ценятся за их высокую термическую и химическую стабильность и низкую температуру стеклования . Некоторые гексалкоксифосфазены находят коммерческое применение в качестве огнестойких материалов и высокотемпературных смазок.
Производные полифосфазена
Полифосфазены, полученные из полимеризованного гексахлорфосфазена ( полидихлорфосфазена ), привлекли внимание в области неорганических полимеров и стали предметом исследований свойств эластомерных и термопластичных производных. Некоторые из них кажутся многообещающими для будущих применений в качестве волокнообразующих или мембранообразующих материалов с высокими рабочими характеристиками, поскольку они сочетают в себе прозрачность, гибкость основной цепи , регулируемую гидрофильность или гидрофобность , а также различные другие желательные свойства .
В настоящее время компоненты из полифосфазенового каучука в коммерческих целях находят применение в уплотнительных кольцах , топливопроводах и амортизаторах , где полифосфазены придают огнестойкость, непроницаемость для масел и гибкость даже при очень низких температурах.
дальнейшее чтение
- Открытие циклофосфазенов: Liebig-Wöhler, Briefwechsel vol. 1, 63; Анна. Chem. (Либих), т. 11 (1834), 146.
- Первые сообщения об их полимеризации: HN Stokes (1895), О хлорнитридах фосфора . Американский химический журнал, т. 17, стр. 275. Н. Стокс (1896 г.), О триметафосфимовой кислоте и продуктах ее разложения. Американский химический журнал, т. 18 выпуск 8, с. 629.
- Пример синтеза гексалкоксифосфазена из гексахлорфосфазена и описание структуры: Allcock, Harry R .; Ngo, Dennis C .; Парвез, Масуд; Уиттл, Роберт Р .; Бердсолл, Уильям Дж. (1991-03-01). «Синтезы и структуры циклических и короткоцепочечных линейных фосфазенов, несущих 4-фенилфенокси боковые группы» . Журнал Американского химического общества . 113 (7): 2628–2634. DOI : 10.1021 / ja00007a041 . ISSN 0002-7863 .
- Синтез нового гексалкоксифосфазена не исходя из гексахлорфосфазена: Ye, Chengfeng; Чжан, Зефу; Лю, Вэйминь (01.01.2002). «Новый синтез гексазамещенных циклотрифосфазенов» . Синтетические коммуникации . 32 (2): 203–209. DOI : 10,1081 / SCC-120002003 . ISSN 0039-7911 . S2CID 97319633 .



