Стромальная опухоль желудочно-кишечного тракта - Gastrointestinal stromal tumor
| Стромальная опухоль желудочно-кишечного тракта | |
|---|---|
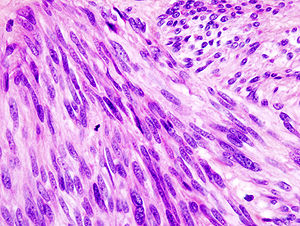 | |
| Гистопатологическое изображение желудочно-кишечной стромальной опухоли желудка. Окраска гематоксилин-эозином. | |
| Специальность | Онкология |
| Дифференциальная диагностика | Внематочная поджелудочная железа |
Желудочно - кишечные стромальные опухоли ( ЖКСО ) являются наиболее распространенными мезенхимальными опухолями по желудочно - кишечному тракту . ГИСО возникают в интерстициальной клетке водителя ритма гладких мышц Кахаля или подобных клетках. Они определяются как опухоли, поведение которых определяется мутациями в гене KIT (85%), гене PDGFRA (10%) или киназе BRAF (редко). 95% GIST положительно окрашивают KIT (CD117). Большинство (66%) встречаются в желудке, и желудочные GIST имеют более низкий потенциал злокачественности, чем опухоли, обнаруженные в других местах желудочно-кишечного тракта.
Классификация
GIST был введен в качестве диагностического термина в 1983 г. До конца 1990 - х годов, многие не- эпителиальные опухоли по желудочно - кишечного тракта , не были названы «желудочно - кишечные стромальные опухоли». Гистопатологи не смогли конкретно различить типы, которые, как мы теперь знаем, различаются на молекулярном уровне. Впоследствии CD34 , а затем CD117 были идентифицированы как маркеры, позволяющие различать различные типы. Кроме того, в отсутствие специфической терапии диагностическая категоризация имела лишь ограниченное влияние на прогноз и терапию.
Понимание биологии GIST значительно изменилось с определением молекулярной основы GIST, особенно c-KIT. Исторически сложилось так, что обзоры литературы до молекулярного определения GIST и в течение короткого времени после этого утверждали, что 70-80% GIST были доброкачественными. Идентификация молекулярной основы GIST привела к исключению многих опухолей, которые ранее считались GIST, а также включению гораздо большего числа опухолей, которые были помечены как другие типы сарком и недифференцированных карцином. Например, некоторые ранее поставленные диагнозы лейомиосаркомы желудка и тонкой кишки (злокачественная опухоль гладкой мускулатуры ) будут реклассифицированы как GIST на основании иммуногистохимического окрашивания. Все опухоли GIST в настоящее время считаются потенциально злокачественными, и ни одна опухоль GIST не может быть окончательно классифицирована как «доброкачественная». Следовательно, все GIST соответствуют критериям определения стадии рака в AJCC (7-е издание) / UICC. Тем не менее, разные GIST имеют разные оценки риска их тенденции к повторению или метастазированию, в зависимости от места их происхождения, размера и количества митотических фигур.
Из-за изменения определения клинические методы оказания помощи до 2000 года в значительной степени неинформативны в нынешнюю эпоху.
Признаки и симптомы
ГИСО могут вызывать проблемы с глотанием , желудочно-кишечное кровотечение или метастазы (в основном в печень). Кишечная непроходимость возникает редко из-за внешнего характера роста опухоли. Часто в анамнезе есть неопределенная боль в животе или дискомфорт, и опухоль стала довольно большой к моменту постановки диагноза.
Патофизиология
GIST - это опухоли соединительной ткани , то есть саркомы ; в отличие от большинства опухолей желудочно-кишечного тракта , они не эпителиальные . Около 70% находится в желудке , 20% - в тонком кишечнике и менее 10% - в пищеводе . Маленькие опухоли обычно доброкачественные, особенно при низкой скорости деления клеток . Опухоли GIST обычно метастазируют в печень (в 28% случаев) и / или в большой сальник , малый сальник или брыжейку (в 30% случаев). Менее распространенные области метастазов включают легкие, подкожную клетчатку, лимфатические узлы или кости.
Считается, что GIST возникают из интерстициальных клеток Кахаля (ICC), которые обычно являются частью вегетативной нервной системы кишечника. Они выполняют функцию кардиостимулятора, контролируя моторику .
Генетика
Большинство GIST являются спорадическими. Менее 5% возникают как часть наследственных семейных или идиопатических многоопухолевых синдромов. К ним относятся, в порядке убывания частоты, нейрофиброматоз Реклингхаузена (NF-1), триада карнея (GIST желудка, легких хондрома и экстра- надпочечников параганглиома ), зародышевые усиления из-функции мутации в с-Kit / PDGFRA , и Carney- Синдром Стратакиса . Синдром Карни-Стратакиса представляет собой диаду наследственной GIST и параганглиомы, которая вызвана мутациями зародышевой линии в пути гена-супрессора митохондриальной опухоли с участием субъединиц SDHD , SDHC и SDHB сукцинатдегидрогеназы (SDH) .
c-KIT мутации
Примерно 85% GIST связаны с аномальным путем c-KIT . c-KIT - это ген, который кодирует трансмембранный рецептор фактора роста, называемого фактором стволовых клеток ( scf ). Аномальный путь c-KIT чаще всего (85%) возникает из-за мутации самого гена; меньшее подмножество с-KIT-ассоциированной ЖКСО связанно с конститутивной активностью от KIT ферментативного пути , найденная иммуноблоттинги . Продукт c-KIT / CD117 экспрессируется на ICC и большом количестве других клеток, в основном клетках костного мозга , тучных клетках , меланоцитах и некоторых других. В кишечнике, однако, массовое окрашивание с положительным результатом на CD117 , вероятно, будет GIST, происходящим от клеток ICC.
С-KIT молекула содержит длинный внеклеточный домен , а трансмембранный сегмент , и внутриклеточную часть. Мутации обычно происходят в ДНК, кодирующей внутриклеточную часть (экзон 11), которая действует как тирозинкиназа для активации других ферментов . Мутации делают функцию c-KIT независимой от активации scf , что приводит к высокой скорости деления клеток и, возможно, нестабильности генома. Дополнительные мутации, вероятно, «требуются» для того, чтобы клетка с мутацией c-KIT превратилась в GIST, но мутация c-KIT, вероятно, является первым шагом этого процесса.
Известно, что мутации в экзонах 11, 9 и редко 13 и 17 гена c-KIT происходят в GIST. Тирозинкиназы функция с-KIT имеет важное значение в медицинской терапии для ЖКСО, как описано ниже.
- Точечные мутации KIT-D816V в экзоне 17 c-KIT ответственны за устойчивость к лекарственным средствам таргетной терапии, таким как мезилат иматиниба , ингибитор тирозинкиназы.
- KIT-p.D419del (экзон 8) - подмножество опухолей стромы желудочно-кишечного тракта, ранее считавшихся опухолями дикого типа, несет соматические активирующие мутации в экзоне 8 KIT (p.D419del).
Мутации PDGFRA
Большинство клеток GIST с c-kit дикого типа (т.е. без мутации) вместо этого имеют мутацию в другом гене, PDGFR-α ( рецептор альфа-фактора роста тромбоцитов ), который является родственной тирозинкиназой. Мутации в c-kit и PDGFrA исключают друг друга [4] [5] .
Опухоли дикого типа
Меньшее количество GIST, по-видимому, не связано ни с аномалиями c-kit, ни с PDGFR-α. Около 10-15% желудочно-кишечных стромальных опухолей (GIST) несут последовательности дикого типа во всех горячих точках KIT и рецептора фактора роста тромбоцитов альфа (PDGFRA) (wt-GIST). Эти опухоли в настоящее время определяются отсутствием мутаций в экзонах 9, 11, 13 и 17 гена KIT и экзонах 12, 14 и 18 гена PDGFRA.
Диагностика
Часто проводится компьютерная томография (см. Раздел радиологии ).
Окончательный диагноз ставится с помощью биопсии , которую можно получить эндоскопически , чрескожно под контролем КТ или УЗИ или во время операции. Биопсии образцы будут исследованы под микроскопом с помощью патологоанатома врача. Патолог изучает гистопатологию для определения характеристик GIST (веретенообразные клетки в 70-80%, эпителиальный аспект в 20-30%). Более мелкие опухоли обычно могут быть ограничены слоем мышечной оболочки кишечной стенки. Большие растут, в основном наружу, от стенки кишечника до точки, где они превышают кровоснабжение и некроз (умирают) внутри, образуя полость, которая в конечном итоге может прийти к сообщению с просветом кишечника.
При подозрении на ГИСО - в отличие от других причин подобных опухолей - патолог может использовать иммуногистохимию (специфические антитела , окрашивающие молекулу CD117 [также известную как c-kit ] - см. Ниже). 95% всех GIST являются CD117-положительными (другие возможные маркеры включают CD34 , DOG-1, десмин и виментин ). Другими клетками, которые демонстрируют положительную реакцию на CD117, являются тучные клетки .
Если окраска CD117 отрицательная и остается подозрение, что опухоль является GIST, можно использовать более новое антитело DOG-1 (обнаруженное на GIST-1). Также для подтверждения диагноза можно использовать секвенирование набора и PDGFRA.
Визуализация
Цель рентгенологического исследования - определить местонахождение поражения, оценить признаки инвазии и обнаружить метастазы . Характеристики GIST зависят от размера опухоли и органа происхождения. Диаметр может составлять от нескольких миллиметров до более 30 см. Более крупные опухоли обычно вызывают симптомы, в отличие от случайно обнаруженных, которые, как правило, меньше и имеют лучший прогноз. Большие опухоли, как правило, проявляют злокачественное поведение, но маленькие GIST могут также демонстрировать клинически агрессивное поведение.

Обычные рентгенограммы не очень полезны при оценке ГИСО. Если наблюдается отклонение от нормы, это будет косвенным признаком воздействия опухолевой массы на соседние органы. На рентгенограмме брюшной полости ГИСО желудка могут выглядеть как рентгеноконтрастное образование, изменяющее форму воздушной тени желудка. Кишечные GIST могут смещать петли кишечника, а более крупные опухоли могут блокировать кишечник, и снимки покажут картину обструкции . При наличии кавитации на рентгенограммах можно увидеть скопление воздуха внутри опухоли. Кальцификация - необычная особенность GIST, но, если она присутствует, может быть видна на простых пленках.
Рентгеноскопия с барием и КТ обычно используются для оценки пациента с жалобами на брюшную полость. Изображения с глотанием бария показывают отклонения в 80% случаев GIST. Однако некоторые ГИСО могут располагаться полностью вне просвета кишечника, и их нельзя будет оценить при проглатывании бария. Даже в тех случаях, когда проглатывание бария является ненормальным, необходимо провести МРТ или КТ, поскольку невозможно оценить брюшную полость и другие органы брюшной полости с помощью одной только глотки с барием. При компьютерной томографии отклонения можно увидеть у 87% пациентов, и его следует делать как с пероральным, так и с внутривенным контрастированием. Среди визуализационных исследований МРТ имеет лучший тканевой контраст, который помогает идентифицировать образования в желудочно-кишечном тракте (интрамуральные образования). Для оценки васкуляризации очага поражения необходимо внутривенное введение контрастного вещества.
Предпочтительными методами визуализации при оценке GIST являются КТ и МРТ, а в некоторых случаях - эндоскопическое ультразвуковое исследование. К преимуществам КТ относится ее способность демонстрировать доказательства инвазии соседних органов, асцита и метастазов. Способность МРТ создавать изображения в нескольких плоскостях помогает определить кишечник как исходный орган (что сложно при очень больших размерах опухоли), облегчая диагностику.
Маленькие ГИСО
Поскольку ГИСО возникают из слоя кишечника, называемого собственно мышечной оболочкой (который находится глубже слизистой и подслизистой оболочки с точки зрения просвета ), визуализация малых ГИСО обычно указывает на подслизистый отросток или образование в стенке кишечника. В исследованиях проглатывания бария эти GIST чаще всего представлены гладкими границами, образующими прямые или тупые углы с близлежащей стенкой кишечника, как это видно с любыми другими интрамуральными образованиями. Поверхность слизистой оболочки обычно не повреждена, за исключением участков изъязвлений, которые обычно присутствуют в 50% GIST. Изъязвления заполняются барием, вызывая появление целевого очага или очага поражения. На КТ с контрастным усилением маленькие GIST видны как гладкие, четко очерченные интрамуральные образования с однородным затуханием.
Крупные GIST
По мере роста опухоль может выступать за пределы кишечника (экзофитный рост) и / или внутрь кишечника (внутрипросветный рост), но чаще всего они растут экзофитически, так что большая часть опухоли выступает в брюшную полость. Если опухоль опережает кровоснабжение, она может некроз изнутри, создавая центральную полость, заполненную жидкостью, с кровотечением и кавитациями, которые в конечном итоге могут изъязвляться и попадать в просвет кишечника. В этом случае проглатывание бария может показать уровни воздуха, воздуха и жидкости или скопление перорального контрастного вещества в этих областях. Также могут присутствовать язвы на слизистой оболочке. В отличие от КТ-изображений с контрастным усилением, большие ГИСО выглядят как неоднородные массы из-за областей живых опухолевых клеток, окружающих кровотечение, некроз или кисты, что рентгенологически видно как периферический образец усиления с низким центром затухания. В исследованиях МРТ степень некроза и кровотечения влияет на характер интенсивности сигнала. Области кровотечения в опухоли будут различать интенсивность сигнала в зависимости от того, как давно произошло кровотечение. Твердые участки опухоли обычно имеют низкую интенсивность сигнала на T1-взвешенных изображениях , имеют высокую интенсивность сигнала на T2-взвешенных изображениях и усиливаются после введения гадолиния . Пустоты интенсивности сигнала присутствуют, если есть газ в областях некротической опухоли.
Особенности злокачественности
Злокачественность характеризуется местной инвазией и метастазами, обычно в печень , сальник и брюшину . Однако были зарегистрированы случаи метастазов в кости, плевру , легкие и забрюшинное пространство . В отличие от аденокарциномы желудка или лимфомы желудка / тонкой кишки , злокачественная лимфаденопатия (увеличение лимфатических узлов) встречается редко (<10%), и поэтому визуализация обычно показывает отсутствие увеличения лимфатических узлов. Если метастазов нет, другие рентгенологические признаки, указывающие на злокачественность, включают: размер (> 5 см), неоднородное усиление после введения контрастного вещества и изъязвления. Кроме того, явно злокачественное поведение (в отличие от злокачественного потенциала меньшей степени) реже наблюдается при опухолях желудка, с соотношением поведенчески доброкачественных и явно злокачественных опухолей 3-5: 1. Даже если присутствуют рентгенологические злокачественные признаки, эти результаты могут также относиться к другим опухолям, и окончательный диагноз должен быть поставлен иммунохимически .
Управление
Для локализованных операбельных GIST у взрослых, если это возможно с анатомической и физиологической точек зрения, хирургическое вмешательство является основным методом выбора. Хирургия может быть потенциально излечивающей, но при небольших опухолях можно рассмотреть возможность осторожного ожидания в тщательно отобранных ситуациях. Может быть рекомендовано послеоперационное адъювантное лечение. Метастазы в лимфатические узлы редки, и обычное удаление лимфатических узлов обычно не требуется. Лапароскопическая хирургия, минимально инвазивная операция на брюшной полости с использованием телескопов и специализированных инструментов, оказалась эффективной для удаления этих опухолей без необходимости делать большие разрезы. Клинические вопросы точных хирургических показаний к размеру опухоли противоречивы. Решение о подходящей лапароскопической операции зависит от размера, расположения и характера роста опухоли.
Лучевая терапия исторически не была эффективной для GIST, и GIST не реагируют на большинство химиотерапевтических препаратов, с ответами менее 5%. Тем не менее, три препарата были идентифицированы для клинической пользы в GIST: иматиниб , сунитиниб и регорафениб .
Иматиниб (Glivec / Gleevec), пероральный препарат, первоначально продаваемый для лечения хронического миелолейкоза на основе ингибирования bcr-abl , также ингибирует как мутации тирозинкиназы c-kit, так и мутации PDGFRA, отличные от D842V, полезен при лечении GIST в нескольких ситуациях. Иматиниб использовался в отдельных случаях неоадъювантной терапии . В условиях адъювантного лечения большинство опухолей GIST излечиваются хирургическим путем и не нуждаются в адъювантной терапии. Исключение составляют случаи, когда анатомическое положение опухоли означает, что операция технически трудна или сложна. Например, ректальный GIST часто требует радикального хирургического вмешательства для достижения полной резекции, включая абдоминоперинеальную резекцию и постоянную стому . В этих ситуациях использование неоадъювантного иматиниба может значительно уменьшить как размер опухоли, так и митотическую активность, а также сделать менее радикальную операцию по сохранению сфинктера.
Значительная часть опухолей GIST имеет высокий риск рецидива, по оценке ряда проверенных схем стратификации риска, и может быть рассмотрена для адъювантной терапии. Критерии выбора, лежащие в основе решения о возможном использовании иматиниба в этих условиях, включают оценку риска, основанную на патологических факторах, таких как размер опухоли, скорость митоза и местоположение, которые могут использоваться для прогнозирования риска рецидива у пациентов с GIST. Было показано, что опухоли <2 см с митотической скоростью <5/50 HPF имеют более низкий риск рецидива, чем более крупные или более агрессивные опухоли. После хирургической резекции ГИСО адъювантное лечение иматинибом снижает риск рецидива заболевания в группах повышенного риска. В отдельных случаях адъювантного лечения повышенного риска иматиниб рекомендуется в течение 3 лет.
Иматиниб был одобрен FDA США для лечения метастатического и неоперабельного ГИСО 1 февраля 2002 г. После лечения иматинибом двухлетняя выживаемость пациентов с запущенным заболеванием увеличилась до 75–80%.
Если встречается резистентность к иматинибу, можно рассмотреть возможность применения ингибитора множественных тирозинкиназ сунитиниб (продаваемый как Сутент).
Эффективность иматиниба и сунитиниба зависит от генотипа. Опухоли GIST с отрицательными мутациями cKIT и PDGFRA обычно устойчивы к лечению иматинибом, как и GIST дикого типа, ассоциированный с нейрофиброматозом- 1. Специфический подтип мутации PDGFRA, D842V, также нечувствителен к иматинибу. Недавно FDA одобрило Авапритиниб для ГИСО с мутацией PDGFRA. Сейчас поступают реальные данные и по авапритинибу (д-р Самир Растоги и др.)
Регорафениб (Стиварга) был одобрен FDA в 2013 году для применения передовых ГИСО, которые нельзя удалить хирургическим путем и которые больше не реагируют на иматиниб (Гливек) и сунитиниб (Сутент).
Эпидемиология
ГИСО встречаются у 10-20 на миллион человек. Истинная частота может быть выше, поскольку новые лабораторные методы гораздо более чувствительны при диагностике ГИСО. По оценкам, заболеваемость GIST в Соединенных Штатах составляет около 5000 случаев ежегодно. Это делает ГИСО наиболее распространенной формой саркомы , которая включает более 70 типов рака.
Большинство GIST присутствуют в возрасте 50–70 лет. В большинстве возрастных групп частота ГИСО одинакова у мужчин и женщин.
ГИСО взрослых редко встречаются в возрасте до 40 лет. ГИСО для детей считаются биологически разными. В отличие от ГИСО других возрастов, ГИСО в педиатрии чаще встречаются у девочек и молодых женщин. По-видимому, в них отсутствуют онкогенные активирующие мутации тирозинкиназы как в KIT, так и в PDGFRA. Лечение GIST у детей отличается от лечения GIST у взрослых. Хотя общепринятое определение педиатрического GIST - это опухоль, которая диагностируется в возрасте 18 лет или моложе, GIST «педиатрического типа» можно увидеть у взрослых, что влияет на оценку риска, роль резекции лимфатического узла и выбор метода. терапия.
Цитаты
Общие источники
- де Сильва CM, Рид Р. (2003). «Желудочно-кишечные стромальные опухоли (GIST): мутации C-kit, экспрессия CD117, дифференциальная диагностика и таргетная терапия рака с иматинибом» (PDF) . Pathol Oncol Res . 9 (1): 13–9. DOI : 10.1007 / BF03033708 . PMID 12704441 . S2CID 3814815 .
- Китамура Ю., Хирота С., Нишида Т. (апрель 2003 г.). «Желудочно-кишечные стромальные опухоли (GIST): модель для молекулярной диагностики и лечения солидных опухолей» . Cancer Sci . 94 (4): 315–20. DOI : 10.1111 / j.1349-7006.2003.tb01439.x . PMID 12824897 . S2CID 31070671 .
внешние ссылки
- GIST Support UK
- Вопросы по хирургии в GIST ESUN (15 августа 2006 г.)
- SPAEN (EuroNet для пациентов с саркомой) - Европейская сеть групп по защите интересов пациентов с саркомой, GIST и Desmoid
- GIST Support International
- Life Raft Group Международная правозащитная организация GIST
- Руководство для пациентов Американского онкологического общества по опухолям GIST.
- Cancer.Net: Стромальная опухоль желудочно-кишечного тракта
| Классификация | |
|---|---|
| Внешние ресурсы |




