Ванадилнитрат - Vanadyl nitrate
|
|
| Имена | |
|---|---|
| Другие имена
тринитратооксованадий
|
|
| Идентификаторы | |
|
3D модель ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
|
|
|
| Характеристики | |
| VO (NO 3 ) 3 | |
| Молярная масса | 252,953 г / моль |
| Появление | желтая жидкость. |
| Температура плавления | 2 ° С (36 ° F, 275 К) |
| Точка кипения | От 86 до 91 ° C (от 187 до 196 ° F, от 359 до 364 K) при 0,7 мм рт. |
| воды | |
| Опасности | |
| Основные опасности | окислитель |
| Родственные соединения | |
|
Родственные соединения
|
нитрат титана , перхлорат ванадила |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
| Ссылки на инфобоксы | |
Нитрат ванадила , также называемый окситринитратом ванадия или оксинитратом ванадия, представляет собой неорганическое соединение ванадия в степени окисления +5 с нитратными лигандами и кислородом. Формула VO (NO 3 ) 3 . Это бледно-желтая вязкая жидкость.
Производство
Его получают путем вымачивания пятиокиси ванадия в жидкой пятиокиси азота в течение двух дней при комнатной температуре. Выход этого метода составляет около 85%.
- V 2 O 5 + 3 N 2 O 5 → 2 VO (NO 3 ) 3 .
Очистка может быть достигнута вакуумной перегонкой.
Мононитратодиоксованадий (VO 2 NO 3 ) является промежуточным продуктом в этом синтезе. Это твердое тело кирпично-красного цвета.
Нитрат ванадила также может быть получен из трихлорида ванадила VOCl 3 и пятиокиси азота.
Состав
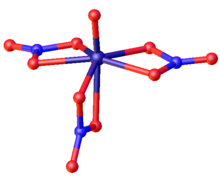
VO (NO 3 ) 3 имеет форму искаженной пятиугольной бипирамиды с идеализированной C s (зеркальной) симметрией. Кислородная связь ванадия (157,2 пм) типична для ванадила (V). Две нитратные группы в пятиугольной плоскости бидентатны (расстояния VO от 199 до 206 пм). Третий нитрат простирается от пятиугольной плоскости (197 пм) до положения транс к оксо (223 пм).
Характеристики
Нитрат ванадила растворяется в дихлорметане, нитрометане, четыреххлористом углероде и насыщенных углеводородах. 1-Гексен или другие ненасыщенные углеводороды воспламеняются при контакте с ванадилнитратом. При контакте с водой необратимо гидролизуется с выделением азотной кислоты . Азотная кислота образуется в результате реакции с водой.
Ультрафиолетовый спектр жидкости показывает полосу поглощения с максимумом при 208 нм с плечом при 242 нм. При 55 ° C газообразный нитрат ванадила имеет полосы поглощения также при 486, 582 и 658 нм в спектре видимого света. в инфракрасной области жидкий нитрат ванадила поглощает 1880, 1633, 1612, 1560, 1306, 1205, 1016, 996, 965, 895, 783, 632, 457, 357, 301, 283, 234, 193, 133, 93 и 59 см -1 . Газообразный нитрат ванадила имеет полосы поглощения при 775, 783, 786, 962,5, 994,4, 997,5, 1000,5, 1006,2, 1012, 1016,3, 1020, 1198, 1211, 1216,3, 1564, 1612, 1629, 1632, 1635, 1648 и 1888 см - 1 . Многие из этих полос обусловлены растяжением связей азот – кислород, но 1016,3 см –1 обусловлены двойной связью ванадий – кислород. 786 происходит из-за сдвига фазы в NO, а 775 из-за деформации в ON = O в плоскости зеркала.
Реакции
Это нитрующий агент для ароматических соединений. Реакции протекают при комнатной температуре. Часто дихлорметан используется в качестве инертного растворителя. Нитротолуол, метилбензоат и бензойная кислота нитрируются при длительном воздействии в течение нескольких дней. Бензонитрил не реагирует.
Нитрат ванадила образует твердый бледно-желтый аддукт с трифторидом бора . Также образуется аддукт с ацетонитрилом .
использованная литература
- ^ a b c d e f Голубь, Майкл Ф. А.; Бертольд Манц; Джон Монтгомери; Джеральд Паттенден; Саймон А. Вуд (1998). «Окситринитрат ванадия (V), VO (NO3) 3. Мощный реагент для нитрования ароматических соединений при комнатной температуре в некислотных условиях». Журнал химического общества, Perkin Transactions 1 (10): 1589–1590. DOI : 10.1039 / A801771I . ISSN 0300-922X .
- ^ a b c Брандан, Сильвия А .; К. Сокольский; Аида Бен Алтабеф (2009). "Расчет методом DFT молекулярного силового поля ванадилнитрата, VO (NO3) 3". Zeitschrift für anorganische und allgemeine Chemie . 635 (3): 582–592. DOI : 10.1002 / zaac.200801244 . ISSN 0044-2313 .
- ^ a b c d e Харрис, Арло Д.; Джон К. Требеллас (26 апреля 1962 г.). "AD296097 Экспериментальные исследования реакций N2O5 с ангидридами кислот металлов и BF3" . Станция Арлингтон-Холл: Агентство технической информации вооруженных сил . Проверено 30 сентября 2014 года .
- ^ Коттон, Ф. Альберт; Уилкинсон, Джеффри (1966). Продвинутая неорганическая химия - всеобъемлющий текст (5-е изд.). Джон Вили. п. 814.
- ^ Пантонин, Джон А .; Альберт К. Фишер; Эдвард А. Хайнц (1960). «Получение мононитратодиоксованадия (V), VO2NO3». Журнал неорганической и ядерной химии . 14 (1–2): 145–147. DOI : 10.1016 / 0022-1902 (60) 80220-5 . ISSN 0022-1902 .
- ^ Шмайссер, Мартин (1955). "Die Chemie der anorganischen Acylnitrate (ein Problem des Nitrylchlorids) und Acylperchlorate (ein Problem des Dichlorhexoxyds)". Angewandte Chemie (на немецком языке). 67 (17–18): 493–501. DOI : 10.1002 / ange.19550671708 . ISSN 0044-8249 .
- ^ Смарт, Брюс A .; Хизер Э. Робертсон; Дэвид У.Х. Рэнкин; Эрик Г. Хоуп; Колин Дж. Марсден (1999). «Каково координационное число ванадия в ванадилнитрате, VO (NO3) 3? Исследование его молекулярной структуры в газовой фазе с помощью дифракции электронов и расчетов ab initio». Журнал химического общества, Dalton Transactions (3): 473–478. DOI : 10.1039 / A806710D . ISSN 0300-9246 . (бесплатная загрузка)
- ^ Дэвидсон, Г. (2000-01-01). Спектроскопические свойства неорганических и металлоорганических соединений . Королевское химическое общество. С. 516–517. ISBN 9780854044269. Проверено 30 сентября 2014 года .
- ^ Федоров, Василий Т; Шеффилд, Оливер Е. Энциклопедия взрывчатых веществ и сопутствующие товары Том 10 10- U до Z . 10 . п. V4.
- ^ a b c Brandán, SA; А. Бен Алтабеф, Э. Л. Варетти; Варетти, Э.Л. (1995). «Колебательные и электронные спектры ванадилнитрата, VO (NO3) 3». Spectrochimica Acta Часть A: Молекулярная и биомолекулярная спектроскопия . 51 (4): 669–675. Bibcode : 1995AcSpA..51..669B . DOI : 10.1016 / 0584-8539 (94) 00154-4 . ISSN 1386-1425 .
- ^ Айткен, Р. Алан; Аладжарин, Матео; Allen, DW; Микаэль Бегтруп; Даниэль Беллус; Дж. Берна-Кановас; Х. Бекемайер; Стефан Брэсе; ИК Батлер; Хосе Кьяра; Анри-Ж. Кристау; И. Горрелл; Д. Кек; Теренс Ки; Кармен Лопес-Леонардо; Т. Мюллер; Патрик Дж. Мерфи; Патрик О'Лири; Беате Привиш; Л.К. Расмуссен; Карола Рюк-Браун; Бьорн Шлюммер; Андреас Шмидт; Пол Джеймс Стивенсон; JC Tebby; Давид Вирьё (14 мая 2014 г.). Наука синтеза: Методы Губена-Вейля молекулярных превращений Vol. 31b: Арен-Х (X = N, P) . Георг Тиме Верлаг. п. 1215. ISBN 9783131720719. Проверено 29 сентября 2014 года .
Другое чтение
- Gmelin, Syst № 48, Teil A и Teil B (Lieferung 1 и 2) (1967); Teil A (Lieferung 1) и Teil A (Lieferung 2) (1968); & Erganzungwerk (Band2) (1971)
- М. Шмайссер, "Химические рефераты", (1955), 49, 10873
- Л. Бретерик, Эд, "Опасности в химической лаборатории", Королевское химическое общество, Лондон, Англ. (1979), стр. 1160
