Омефентанил - Ohmefentanyl
 | |
| Клинические данные | |
|---|---|
| Код УВД | |
| Правовой статус | |
| Правовой статус | |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ЧЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
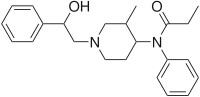
| Формула | C 23 H 30 N 2 O 2 |
| Молярная масса | 366,505 г · моль -1 |
| 3D модель ( JSmol ) | |
| |
| |
| (проверять) | |
Омефентанил (также известный как β-гидрокси-3-метилфентанил , OMF и RTI-4614-4 ) является чрезвычайно сильнодействующим опиоидным анальгетиком, который избирательно связывается с µ-опиоидным рецептором .
Омефентанил - один из самых сильных известных агонистов μ-опиоидных рецепторов , сравнимый с суперсильными опиоидами, такими как карфентанил и эторфин, которые легально используются только для усыпления крупных животных, таких как слоны, в ветеринарии . В исследованиях на мышах наиболее активный изомер 3R, 4S, βS-омефентанил был в 28 раз более сильным болеутоляющим, чем фентанил , химическое вещество, из которого он получен, и в 6300 раз сильнее, чем морфин . Омефентанил имеет три стереогенных центра и восемь стереоизомеров , которые называются F9201 – F9208. Исследователи изучают различные фармацевтические свойства этих изомеров .
4 ″ -фторовый аналог (то есть замещенный в фенетильном кольце) 3R, 4S, βS изомера омефентанила является одним из наиболее эффективных опиоидных агонистов, которые были обнаружены, он обладает анальгетической активностью примерно в 18 000 раз больше, чем морфин. Другие аналоги с эффективностью выше, чем у самого омефентанила, включают 2'-фторпроизводное (т. Е. Замещенное на фенильном кольце анилина) и производные, в которых N-пропионильная группа заменена N-метоксиацетильной или 2-фурамидной группами, или карбоэтоксигруппа добавляется в положение 4 пиперидинового кольца. Последний считается в 30 000 раз более сильнодействующим, чем морфин.
Побочные эффекты аналогов фентанила аналогичны побочным эффектам самого фентанила , которые включают зуд , тошноту и потенциально серьезное угнетение дыхания , которое может быть опасным для жизни. Незаконно используемые аналоги фентанила убили сотни людей по всей Европе и бывшим советским республикам с тех пор, как в Эстонии в начале 2000-х годов началось возрождение его использования , и продолжают появляться новые производные.
Синтез
Смотрите также
Рекомендации
- ^ Ротман, РБ; Хэн Сюй; Seggel, M .; Якобсон, AE; Рис, KC; Рассол, Джорджия; Кэрролл, FI (апрель 1991 г.). «RTI-4614-4: аналог (+) - цис-3-метилфентанила с 27000-кратной селективностью связывания для мю по сравнению с дельта-сайтами связывания опиоидов». Науки о жизни . 48 (23): PL111 – PL116. DOI : 10.1016 / 0024-3205 (91) 90346-D . PMID 1646357 .
- ^ Рассол, Джорджия; Старк, Пенсильвания; Liu, Y .; Кэрролл, ФИ; Singh, P .; Xu, H .; Ротман, РБ (1995). «Энантиомеры диастереомерных цис-N- [1- (2-гидрокси-2-фенилэтил) -3-метил-4-пиперидил] -N-фенилпропанамидов: синтез, рентгеновский анализ и биологическая активность». Журнал медицинской химии . 38 (9): 1547–1557. DOI : 10.1021 / jm00009a015 . PMID 7739013 .
- ^ Ван, ZX; Zhu, YC; Джин, WQ; Чен, XJ; Chen, J .; Ji, RY; Chi, ZQ (сентябрь 1995 г.). «Стереоизомеры N- [1- (2-гидрокси-2-фенилэтил) -3-метил-4-пиперидил] - N-фенилпропанамида: синтез, стереохимия, анальгетическая активность и характеристики связывания с опиоидным рецептором». Журнал медицинской химии . 38 (18): 3652–3659. DOI : 10.1021 / jm00018a026 . PMID 7658453 .
- ↑ HD Banks, CP Ferguson (сентябрь 1988 г.). «Метаболиты фентанила и его производных» (PDF) . Центр химических исследований, разработок и инженерии армии США, Абердинский испытательный полигон, Мэриленд.
- ^ Джин, WQ; Xu, H .; Zhu, YC; Fang, SN; Ся, XL; Хуанг, З.М. Ge, BL; Чи, ZQ (май 1981 г.). «Исследования по синтезу и взаимосвязи между анальгетической активностью и сродством к рецепторам для производных 3-метилфентанила». Scientia Sinica . 24 (5): 710–720. PMID 6264594 .
- ^ Чжу, YC; Wu, RQ; Чжоу, Д.П .; Хуанг, З.М. (декабрь 1983 г.). «Исследования сильнодействующих анальгетиков. VII. Синтез и анальгетическая активность диастереоизомеров 1-бета-гидрокси-3-метилфентанила (7302) и родственных соединений». Яо Сюэ Сюэ Бао = Acta Pharmaceutica Sinica . 18 (12): 900–904. PMID 6679170 .
- ^ Го, GW; Привет.; Джин, WQ; Zou, Y .; Zhu, YC; Чи, ZQ (июнь 2000 г.). «Сравнение физической зависимости стереоизомеров омефентанила у мышей». Науки о жизни . 67 (2): 113–120. DOI : 10.1016 / S0024-3205 (00) 00617-2 . PMID 10901279 .
- ^ Лю, З .; Привет.; Jin, W .; Чен, X .; Shen, Q .; Чи, З. (апрель 2004 г.). «Влияние хронического лечения стереоизомерами омефентанила на образование циклического АМФ в клетках насекомых Sf9, экспрессирующих человеческие μ-опиоидные рецепторы». Науки о жизни . 74 (24): 3001–3008. DOI : 10.1016 / j.lfs.2003.10.027 . PMID 15051423 .
- ^ Yong, Z .; Hao, W .; Weifang, Y .; Qiyuan, D .; Синьцзянь, С .; Wenqiao, J .; Youcheng, Z. (май 2003 г.). «Синтез и анальгетическая активность стереоизомеров цис-фтор-омефентанила» . Die Pharmazie . 58 (5): 300–302. PMID 12779044 .
- ^ Рассола Г.А., Carroll FI, Ричардсон-Leibert Т.М., Xu H, Ротман RB (август 1997). «Омефентанил и его стереоизомеры: химия и фармакология». Современная лекарственная химия . 4 (4): 247–270. ISSN 0929-8673 .
- ^ Mounteney Дж, Giraudon я, Denissov G, Гриффитс Р (июль 2015). «Фентанилы: мы упускаем из виду признаки? Очень сильнодействующий, и его рост в Европе». Международный журнал наркополитики . 26 (7): 626–631. DOI : 10.1016 / j.drugpo.2015.04.003 . PMID 25976511 .
Внешние ссылки
- Омефентанил в Национальной медицинской библиотеке США по предметным заголовкам по медицинским предметам (MeSH)


