Эпотилон - Epothilone
| Эпотилоны | |
|---|---|

Эпотилоны A (R = H) и B (R = CH 3 ) |
|
| Химические формулы |
A: C 26 H 39 NO 6 S |
| Молекулярные массы |
A: 493,66 г / моль |
| Номера CAS |
А: 152044-53-6 |
| PubChem |
А: 448799 |

Эпотилоны C (R = H) и D (R = CH 3 ) |
|
| Химические формулы |
C: C 26 H 39 NO 5 S |
| Молекулярные массы |
C: 477,66 г / моль |
| Номера CAS |
Д: 189453-10-9 |
| PubChem |
C: 9891226 |

Эпотилоны E (R = H) и F (R = CH 3 ) |
|
| Химические формулы |
E: C 26 H 39 NO 7 S |
| Молекулярные массы |
E: 509,66 г / моль |
| Отказ от ответственности и ссылки | |
В эпотилонах представляют собой класс потенциальных противоопухолевых препаратов. Подобно таксанам , они предотвращают деление раковых клеток за счет взаимодействия с тубулином , но в ранних исследованиях эпотилоны обладают большей эффективностью и более мягкими побочными эффектами, чем таксаны.
По состоянию на сентябрь 2008 г. эпотилоны от A до F были идентифицированы и охарактеризованы. Ранние исследования линий раковых клеток и пациентов с раком человека показали более высокую эффективность по сравнению с таксанами . Их механизм действия похож, но их химическая структура проще. Из-за их лучшей растворимости в воде кремофоры (солюбилизирующие агенты, используемые для паклитаксела, которые могут влиять на сердечную функцию и вызывать тяжелую гиперчувствительность) не нужны. Эндотоксиноподобные свойства, известные у паклитаксела, такие как активация макрофагов, синтезирующих воспалительные цитокины и оксид азота, не наблюдаются для эпотилона B.
Первоначально эпотилоны были идентифицированы как метаболиты, продуцируемые миксобактериями Sorangium cellulosum, обитающими в почве .
История
Структура эпотилона А была определена в 1996 году с помощью рентгеновской кристаллографии .
Механизм действия
Главный механизм класса эпотилонов - ингибирование функции микротрубочек . Микротрубочки необходимы для деления клеток, поэтому эпотилоны не позволяют клеткам делиться должным образом. Эпотилон B обладает теми же биологическими эффектами, что и паклитаксел, как in vitro, так и в культивируемых клетках. Это потому, что они имеют один и тот же сайт связывания, а также сродство связывания с микротрубочкой. Подобно паклитакселу, эпотилон B связывается с субъединицей гетеродимера αβ-тубулина. После связывания скорость диссоциации αβ-тубулина снижается, таким образом стабилизируя микротрубочки. Кроме того, было показано, что эпотилон B вызывает полимеризацию тубулина в микротрубочки без присутствия GTP. Это вызвано образованием пучков микротрубочек по всей цитоплазме. Наконец, эпотилон B также вызывает остановку клеточного цикла в фазе перехода G2-M, что приводит к цитотоксичности и, в конечном итоге, к апоптозу клеток. Способность эпотилона ингибировать функцию веретена обычно связывают с его подавлением динамики микротрубочек; но недавние исследования показали, что подавление динамики происходит при более низких концентрациях, чем те, которые необходимы для блокирования митоза. При более высоких концентрациях антимитотиков паклитаксел, по-видимому, действует, подавляя отслоение микротрубочек от центросом, процесс, который обычно активируется во время митоза. Вполне возможно, что эпотилон также может действовать по аналогичному механизму.
Аналоги, разрешенные для медицинского применения
Один из аналогов, иксабепилон , был одобрен в октябре 2007 г. Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для использования в лечении агрессивного метастатического или местно-распространенного рака груди, больше не поддающегося лечению доступными в настоящее время химиотерапевтическими препаратами. В ноябре 2008 года EMEA отказало в разрешении на продажу иксабепилона.
Клинические испытания
Несколько синтетических аналогов эпотилона в настоящее время проходят клиническую разработку для лечения различных видов рака.
На нескольких моделях ксенотрансплантатов человека доказано, что эпотилон B обладает сильной противораковой активностью in vivo при допустимых уровнях доз. В результате, эпотилон B ( патупилон ) и различные аналоги по состоянию на 2001 г. проходят различные клинические фазы: патупилон и полностью синтетический сагопилон [SH-Y03757A, ZK-EPO, химическая структура ] проходят фазу II испытаний; BMS-310705 в фазе I испытаний).
Объявлены результаты исследования фазы III иксабепилона (BMS-247550) в сочетании с капецитабином при метастатическом раке молочной железы (2007 г. - привело к одобрению FDA).
Патупилон не прошел III фазу исследования рака яичников в 2010 году.
Утиделон - это генно-инженерный аналог эпотилона, который показал преимущества в исследовании рака груди III фазы при добавлении к капецитабину .
Полный синтез
В связи с высокой эффективностью и клинической необходимостью в лечении рака эпотилоны стали мишенью для синтеза многих веществ . Первой группой, опубликовавшей полный синтез эпотилонов, была SJ Danishefsky et al. в 1996 г. Этот полный синтез эпотилона А был достигнут посредством внутримолекулярной конденсации енолят-альдегида сложного эфира. Другие синтезы эпотилонов были опубликованы Николау , Шинцером, Мульцером и Каррейрой . В этом подходе были сконструированы ключевые структурные элементы - альдегид , глицидолы и кетокислота, которые были связаны с предшественником метатезиса олефинов посредством альдольной реакции и затем этерификационного сочетания. Катализатор Граббса использовали для закрытия бис-концевого олефина соединения-предшественника. Полученные соединения представляют собой цис- и транс-макроциклические изомеры с четкими стереоцентрами . Эпоксидирование цис- и транс-олефинов дает эпотилон А и его аналоги.
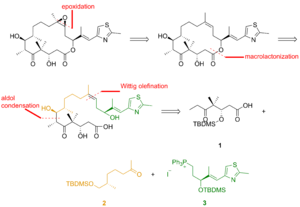
Один из полных синтезов эпотилона B описан ниже и был описан лабораторией KC Nicolaou . Ретросинтетический анализ выявил 1 , 2 и 3 в качестве строительных блоков (Рисунок 1).
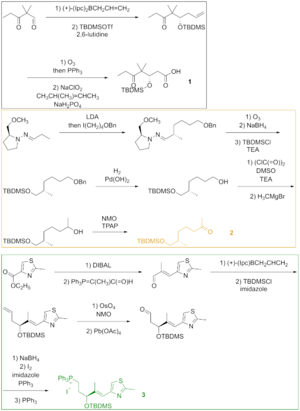
Как видно на фиг. 2, кетокислота 1 была образована из кетоальдегида, который был преобразован в силиловый эфир посредством асимметричного аллилбора и силилирования полученного спирта. Озонолиз из силилового эфира и Линдгрен - Пинник окисление альдегида , получают кетокислоты. Кетон 2 был получен путем алкилирования Эндерса, исходя из гидразона. Озонолиз, последняя стадия алкилирования Эндера, сопровождалось восстановлением альдегида и силилированием образующегося спирта. Гидрогенолиз бензилового эфира дает спирт, который окисляют в условиях Сверна и алкилируют реактивом Гриньяра с получением вторичного спирта. Окисление этого спирта реактивом Лея – Гриффита дает желаемый кетон. Тиазол 3 синтезировали из сложного эфира, который восстанавливали гидридом диизобутилалюминия , и альдегид реагировал со стабилизированным илидом в реакции Виттига . Асимметричное аллилборирование α, β-ненасыщенного альдегида и защита гидроксигруппы давали силиловый эфир, концевой олефин которого реагировал с тетроксидом осмия до диола, который расщеплялся тетраацетатом свинца с образованием альдегида. Восстановление, йодирование и обработка трифенилфосфином привели к фосфониевой соли.
Фрагменты 1 , 2 и 3 реагировали друг с другом для доставки эпотилона B в подходе, включающем реакцию Виттига , альдольную реакцию и этерификацию Ямагучи (фиг. 3). Для разделения диастереомеров использовали препаративную тонкослойную хроматографию .
Биосинтез
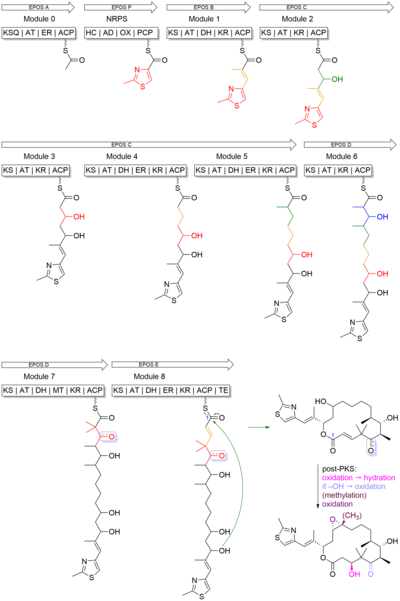
Эпотилон представляет собой 16-членный поликетидный macrolactone метильного тиазола группы , связанную с макроцикл олефиновой связью. Поликетидный скелет был синтезирован поликетидсинтазой I типа (PKS), а тиазольное кольцо было получено из цистеина, включенного нерибосомальной пептидной синтетазой (NRPS). В этом биосинтезе и PKS, и NRPS используют белки-носители , которые были посттрансляционно модифицированы фосфопантетеиновыми группами, чтобы присоединиться к растущей цепи. PKS использует тиоэфир кофермента-A для катализирования реакции и модификации субстратов путем селективного восстановления β-карбонила до гидроксила (кеторедуктаза, KR), алкена (дегидратаза, DH) и алкана (эноилредуктаза, ER). PKS-I может также метилировать α-углерод субстрата. NRPS, с другой стороны, использует аминокислоты, активированные ферментом, как аминоациладенилаты. В отличие от PKS, в ферменте NRPS происходит эпимеризация , N-метилирование и образование гетероцикла.
Эпотилон B начинается с начальной единицы 2-метил-4-карбокситиазола, которая была образована посредством трансляционного связывания между PKS, модулем EPOS A (epoA) и модулем NRPS, EPOS P (epoP). EPOS A содержит модифицированную β-кетоацилсинтазу (малонил-ACP декарбоксилазу, KSQ), ацилтрансферазу (AT), еноилредуктазу (ER) и домен белка-носителя ацила (ACP). Однако EPOS P содержит домен гетероцилирования, аденилирования, оксидазы и тиолированный домен. Эти домены важны, потому что они участвуют в образовании пятичленного гетероциклического кольца тиазола. Как видно на рисунке 4 , EPOS P активирует цистеин и связывает активированный цистеин как аминоацил-S-PCP. После связывания цистеина EPOS A загружает ацетатную единицу в комплекс EPOS P, тем самым инициируя образование тиазолинового кольца за счет внутримолекулярной циклодегидратации.
После образования 2-метилтиазольного кольца оно переносится в PKS EPOS B (epoB), EPOS C (epoC), EPOS D (epoD), EPOS E (epoE) и EPOS F (epoF) для последующего удлинения. и модификация для образования олефиновой связи, 16-членного кольца и эпоксида, как показано на Фигуре 5 . Следует отметить один важный момент - синтез гем-диметильного звена в модуле 7. Эти два диметила не были синтезированы двумя последовательными С-метилированием. Вместо этого одна метильная группа была получена из пропионатного удлинителя, в то время как вторая метильная группа была интегрирована с помощью домена C-метилтрансферазы.