Кадгерин-катениновый комплекс в обучении и памяти - Cadherin–catenin complex in learning and memory
Долгосрочная потенциация (ДП), которая считается клеточной основой обучения и памяти, включает в себя специфический процесс передачи сигналов, лежащий в основе синаптической пластичности. Среди многих механизмов , ответственных за поддержание синаптической пластичности является кадгерином - катенин комплекс. Образуя комплексы с внутриклеточными белками катенина , нейральные кадгерины ( N-кадгерины ) служат связующим звеном между синаптической активностью и синаптической пластичностью и играют важную роль в процессах обучения и памяти.
Считается, что N-кадгерины участвуют в обеспечении LTP и синаптических изменениях, лежащих в основе обучения и памяти. Во время эмбрионального развития кадгерины изначально широко распространены, но постепенно они становятся более локализованными в пре- и постсинаптических сайтах, в то время как синапсы формируются. Блокирование функции кадгерина с помощью определенных белков не влияет на базальные синаптические свойства, но может нарушать индукцию LTP.
Структурная функция и адгезия
Структура кадгерин-катенинового комплекса
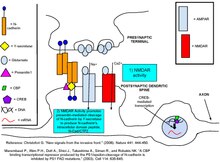
N-кадгерины - это трансмембранные белки, экспрессирующиеся в большинстве синапсов ЦНС. N-кадгерины чаще всего экспрессируются как в пресинаптической активной зоне, так и в областях постсинаптической плотности (PSD), и содержат как внеклеточные домены связывания Ca2 +, так и внутриклеточные домены для связывания своих белков-партнеров. Общим партнером по связыванию для кадгеринов являются белки внутриклеточных катенинов, в частности, трех различных подтипов: α-катенины, β-катенины и катенины семейства p120ctn. β-катенины и p120ctns связывают внутриклеточный домен кадгерина в дистальных и проксимальных областях соответственно. α-катенины, когда они находятся в мономерной форме, будут связываться с комплексом кадгерин-катенин через β-катенины. В гомодимерной форме α-катенины не связывают β-катенины, но предпочтительно связывают F-актин и другие белки, способствующие полимеризации F-актина. Каждый подтип катенина и его взаимодействие с кадгеринами играет особую роль в обеспечении синаптической пластичности и структуры шипа.
Регулирование адгезии
Данные свидетельствуют о том, что N-кадгерины стабилизируют связь между пресинаптическим окончанием и постсинаптическим позвоночником и что эта стабилизация увеличивает вероятность того, что высвобожденный глутамат будет связывать рецепторы на постсинаптическом нейроне. На базовых уровнях синаптической активности N-кадгерины в основном являются мономерами и поэтому слабо адгезивны с кадгеринами, расположенными в клетке на противоположной стороне синапса. Приток Ca2 + через NMDAR способствует димеризации N-кадгеринов. Димеризованные кадгерины легко связываются со своими пресинаптическими кадгеринами-партнерами. Ингибирование связывания N-кадгерина посредством блокирующих антител предотвращает индукцию долгосрочной L-потенциации поздней фазы, что позволяет предположить, что адгезионные свойства димерного N-кадгерина необходимы для L-LTP поздней фазы. Кроме того, KCl-деполяризация пресинаптического аксона как придает протеазную устойчивость к N-кадгеринам, так и рассеивает их по всей PSD от их исходной кластеризации в синаптических точках, тем самым увеличивая их эффективность для клеточной адгезии.
Адгезия N-кадгерина дополнительно стабилизирует синапс, обеспечивая расширение головы позвоночника, вызванное активацией AMPAR. Это морфологическое изменение помогает предотвратить дальнейшие синаптические модификации, которые могут поставить под угрозу информацию, содержащуюся в уже существующих синаптических связях. Расширение головы позвоночника достигает этого за счет уменьшения отношения NMDAR к AMPAR, создавая пропорционально меньший приток кальция, а также за счет более быстрой диффузии кальция из позвоночника. Быстрое удаление кальция не позволяет ему инициировать посттрансляционные модификации, которые в дальнейшем изменяли бы синаптическую силу. Избыточная экспрессия мутанта N-кадгерина, неспособного к адгезии, предотвращает расширение головы позвоночника, демонстрируя существенную роль N-кадгерина в этом процессе.
Регулирование уровней, оборота и стабильности поверхности кадгерина.
Механизмы регуляции различаются потребностями в синтезе и временной инициацией. Одним из способов регуляции кадгерина является стабилизация поверхности, довольно быстрый процесс (происходящий примерно через 100 минут после активности), который не зависит от синтеза белка.
Активность NMDAR снижает фосфорилирование β-катенина по tyr-654, тем самым ингибируя эндоцитоз N-кадгерина и облегчая удерживание и экспрессию на поверхности.
Экспрессия на поверхности также регулируется посредством адгезии, опосредованной протокадгерином . Протокадгерин-альфа и протокадгерин-гамма взаимодействуют с образованием белкового комплекса, который усиливает поверхностную экспрессию каждого подтипа кадгерина.
Экспрессия кадгерина также регулируется интернализацией, индуцированной активностью, которая происходит намного позже стабилизации поверхности (в среднем через 4 часа после стимула). Интернализация зависит от синтеза белка, а белки катенина p120 (p120ctn) участвуют в обмене, деградации и «кластеризации» кадгеринов в адгезивные соединения в синапсе. Считается, что белки ctn P120 либо ингибируют эндоцитоз нейральных кадгеринов, либо действуют на поверхности клетки, контролируя оборот кадгерина. Подавление p120 ctn ведет к большему эндоцитозу кадгерина и предотвращает адгезию между пре- и постсинаптическим нейроном. Такие данные убедительно свидетельствуют о том, что p120 необходим для стабильности кадгерина.
Связывание и сигнализация
Партнеры внутриклеточного связывания
β-катенин локализует везикулы резервного пула (RPV) в пресинаптических участках. Удаление β-катенина in vivo приводит к уменьшению количества RPV, локализованных в синаптическом сайте, и увеличению RPV, рассредоточенных вдоль аксона. Более того, RPV не реагировали на непрерывные серии стимуляции пресинаптического нейрона при нокауте B-катенина. Этот эффект B-катенина не зависит от адгезии, опосредованной кадгерином, и вместо этого модулируется белками, связывающими PDZ, такими как Veli, с кадгерином. Кроме того, передача сигналов BDNF / TrkB ведет к фосфорилированию β-catenin по его сайту Y654, вызывая растворение комплекса β-catenin-cadherin и, следовательно, увеличивая подвижность синаптических пузырьков . Катенины также связывают многие каркасные белки, рецепторы, киназы и фосфатазы. Например, комплекс кадгерин-α-катенин связывает актиновый цитоскелет, хотя неизвестно, связывается ли он посредством связывающих белков или прямых взаимодействий.
Пути передачи сигнала
p120ctn передает сигналы через факторы обмена гуаниновых нуклеотидов (GEF) и GAP для активации семейства Rho GTPases . RhoA должен ингибироваться P120ctn для поддержания плотности и длины шипов. Ингибирование Rac (GTPase) устраняет снижение плотности шипов при дефиците p120ctn. Связывание E-кадгерина с p120ctn может активировать SRC, что приводит к активации Rac1, что приводит к фосфорилированию LIMK1 и LIMK2, чтобы дезактивировать кофилин, вызывающий полимеризацию G-актина. Между тем, фосфорилирование PI3K с помощью SRC активирует RhoA, что приводит к активации кофилина-P и разрушению нитчатого актина. Когда ген WAVE-1 был нарушен у мышей, это привело к когнитивным дефектам, таким как потери в обучении и памяти, связанные с ветвью WAVE-1 пути Rac. Используя модель LTP зубчатой извилины in vivo, было показано, что индукция LTP связана с увеличением F- актина в дендритных шипах, и это долговременное изменение. Было показано, что для этого эффекта требуется активация рецептора NMDA. Более того, использование латрункулина A способно нарушить LTP в поздней фазе в этой модели, что снова указывает на то, что ремоделирование актина необходимо для LTP.
Клеточная функция
Роль в передаче / стабильности рецепторов
Когда белок, связывающий глутаматный рецептор, ABP и p120ctn коэкспрессируются, сыворотка анти-p120ctn вытягивает комплекс, содержащий оба белка, из клеточных лизатов. То же самое происходит с белком, похожим на ABP, который называется GRIP. Скрининг кДНК и анализы спаривания дрожжей демонстрируют, что мотив связывания домена PDZ на С-конце p120ctn делает возможными такие взаимодействия. Данные Co-IP показывают, что p120ctn может одновременно образовывать комплекс с кадгерином и ABP или GRIP. Доминантно-отрицательные фрагменты p120ctn, которые не могли взаимодействовать с ABP и GRIP, нарушали стабилизацию субъединиц GluR2 и GluR3 AMPAR, соответственно, на плазматической мембране . Совместная локализация p120ctn с PSD-95 указывает на то, что комплексы cadherin-p120ctn-ABP / GRIP заякоривают AMPARs в постсинаптической плотности , но неясно, происходит ли закрепление также в перисинаптических сайтах.
Регулирование экспрессии генов
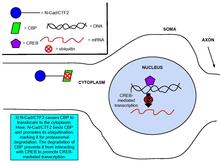
Было показано, что кадгерины и катенины участвуют в регуляции экспрессии генов, важном процессе синаптической пластичности. Связывание глутамата с NMDA усиливает продукцию пептида внутриклеточного домена N-кадгерина, N-cad / CTF2, эффект блокируется антагонистом рецептора NMDA , APV. Трансфекция N-cad / CTF2 снижает ядерный CBP ( CREB-связывающий белок ) и увеличивает цитозольный CBP. Кроме того, N-cad / CTF2 коиммунопреципитирует с CBP, и трансфекция N-cad / CTF2 снижает уровни устойчивого состояния CBP, следовательно, нарушая образование CREB- содержащего комплекса ДНК (см. Рисунки справа).
Экспрессия фактора связывания лимфоидного энхансера 1 (LEF-1) запускает транслокацию β-катенина в ядро , где он усиливает транскрипцию, а трансфекция N-кадгерина или α-катенина отменяет этот эффект. Кроме того, обработка нейронов агонистом NMDAR вызывает расщепление N-конца β-катенина , и C-концевые фрагменты перемещаются в ядро, где, как показывают эксперименты по трансфекции, β-катенин увеличивает транскрипцию, зависимую от Т-клеточного фактора (TCF).