Кадгерин - Cadherin

Кадгерины (названные в честь «кальций-зависимой адгезии») представляют собой тип молекулы клеточной адгезии (CAM), которые важны в формировании адгезионных соединений, позволяющих клеткам прилипать друг к другу. Кадгерины представляют собой класс типа 1 трансмембранных белков , и они зависят от кальция (Са 2+ ) ионов к функции, отсюда их название. Адгезия между клетками опосредуется внеклеточными доменами кадгерина, тогда как внутриклеточный цитоплазматический хвост связан с многочисленными адаптерами и сигнальными белками, которые вместе называются адгезомами кадгерина .
Семейство кадгеринов важно для поддержания межклеточного контакта и регулирования комплексов цитоскелета. Суперсемейство кадгеринов включает кадгерины, протокадгерины , десмоглеины , десмоколлины и другие. В структуре, они разделяют кадгерин повторов , которые являются внеклеточный Ca 2+ - связывающие домены . Существует несколько классов молекул кадгерина, каждый из которых обозначается префиксом (в общем, с указанием типов ткани, с которой он связан). Классические кадгерины поддерживают тонус тканей, образуя гомодимер в цис-цис, в то время как десмосомальные кадгерины являются гетеродимерными. Внутриклеточная часть классических кадгеринов взаимодействует с комплексом белков, который позволяет связываться с актиновым цитоскелетом. Хотя классические кадгерины принимают участие в формировании клеточного слоя и формирования структуры, десмосомные кадгерины сосредоточены на сопротивлении повреждению клеток. Десмосомальные кадгерины отвечают за поддержание функции десмосом, которая заключается в снятии механического напряжения тканей. Подобно классическим кадгеринам, десмосомальные кадгерины имеют один трансмембранный домен, пять повторов ЭК и внутриклеточный домен. Существуют два типа десмосомальных кадгеринов, которые называются десмоглеинами и десмоколлинами, которые содержат внутриклеточный якорь и кадгерин-подобную последовательность (ICS). Адаптерные белки, которые связываются с десмосомными кадгеринами, представляют собой плакоглобин (родственный -катенину), плакофилины (подсемейство катенина p120) и десмоплакины. Основная функция десмоплакинов - связывание с промежуточными филаментами, полное взаимодействие с плакоглобином, который присоединяется к ICS десмоглеинов, десмоколлинов и плакофилинов. Типичные кадгерины отличаются от других типов кадгеринов и состоят из одного или нескольких внеклеточных повторяющихся доменов. Компоненты, которые создают атипичный кадгерин, - это фламинго (семипроходная трансмембранная) и Dcad102F-подобные кадгерины. Их работа состоит в том, чтобы принимать участие в сигнальном пути, а не выполнять межклеточную адгезию.
Было замечено, что клетки, содержащие определенный подтип кадгерина, имеют тенденцию группироваться вместе, исключая другие типы, как в культуре клеток, так и во время развития . Например, клетки, содержащие N-кадгерин, имеют тенденцию к кластеризации с другими клетками, экспрессирующими N-кадгерин. Однако было отмечено, что скорость перемешивания в экспериментах с культурами клеток может влиять на степень гомотипической специфичности. Кроме того, несколько групп наблюдали гетеротипическое сродство связывания (т.е. связывание разных типов кадгерина вместе) в различных анализах. Одна современная модель предполагает, что клетки различают подтипы кадгерина на основе кинетической специфичности, а не термодинамической специфичности, поскольку разные типы гомотипических связей кадгерина имеют разное время жизни.
Состав
Кадгерины синтезируются в виде полипептидов и претерпевают множество посттрансляционных модификаций, чтобы стать белками, которые опосредуют межклеточную адгезию и распознавание. Эти полипептиды состоят приблизительно из 720–750 аминокислот. Каждый кадгерин имеет небольшой C-концевой цитоплазматический компонент, трансмембранный компонент, а остальная часть белка является внеклеточной (вне клетки). Трансмембранный компонент состоит из одноцепочечных гликопротеиновых повторов. Поскольку кадгерины зависят от Ca 2+ , они имеют пять тандемных повторов внеклеточных доменов, которые действуют как сайт связывания для ионов Ca 2+ . Их внеклеточный домен взаимодействует с двумя отдельными транс- димерными конформациями: димерами с заменой цепи (S-димеры) и X-димерами. На сегодняшний день идентифицировано и секвенировано более 100 типов кадгеринов у человека.
Функциональность кадгеринов зависит от образования двух идентичных субъединиц, известных как гомодимеры. Гомодимерные кадгерины создают межклеточную адгезию с кадгеринами, присутствующими в мембранах других клеток, путем изменения конформации с цис -димеров на транс- димеры. Как только сформируется межклеточная адгезия между кадгеринами, присутствующими в клеточных мембранах двух разных клеток, могут быть образованы слипчивые соединения, когда белковые комплексы, обычно состоящие из α-, β- и γ-катенинов , связываются с цитоплазматической частью кадгерин. Регуляторные белки включают катенин p-120, -катенин, -катенин и винкулин . Связывание катенина p-120 и -катенина с гомодимером увеличивает стабильность классического кадгерина. -катенин задействован комплексом p120-катенин, где винкулин задействован, чтобы играть роль в косвенной ассоциации с актиновым цитоскелетом. Однако комплекс кадгерин-катенин также может напрямую связываться с актином без помощи винкулина. Более того, сила адгезии кадгерина может увеличиваться за счет дефосфорилирования катенина p120 и связывания -катенина и винкулина.
Функция
Разработка
Кадгерины действуют как рецепторы и лиганды для других молекул. Во время развития их поведение помогает правильно позиционировать клетки: они несут ответственность за разделение различных слоев ткани и за миграцию клеток. На самых ранних стадиях развития наиболее сильно экспрессируются E-кадгерины (эпителиальный кадгерин). Многие кадгерины предназначены для выполнения определенных функций в клетке, и они по-разному экспрессируются в развивающемся эмбрионе. Например, во время нейруляции , когда у эмбриона формируется нервная пластинка , в тканях, расположенных рядом с черепными нервными складками, снижается экспрессия N-кадгерина. Напротив, экспрессия N-кадгеринов остается неизменной в других регионах нервной трубки, которая расположена на передне-задней оси позвоночного. N-кадгерины имеют разные функции, которые поддерживают клеточную структуру, межклеточную адгезию, внутренние адгезии. Они в значительной степени участвуют в поддержании способности структурированного сердца за счет перекачивания и выпуска крови. Благодаря вкладу N-кадгеринов, прочно прикрепленных между кардиомиоцитами , сердце может преодолеть перелом, деформацию и усталость, которые могут возникнуть в результате кровяного давления. N-кадгерин принимает участие в развитии сердца во время эмбриона, особенно в выделении прекардиальной мезодермы. N-кадгерины сильно экспрессируются в прекардиальной мезодерме, но они не играют роли в сердечной связи. Эмбрион с мутацией N-кадгерина все еще формирует примитивную сердечную трубку; однако мыши с дефицитом N-кадгерина будут иметь трудности в поддержании развития кардиомиоцитов. Миоциты этих мышей в конечном итоге будут диссоциированными миоцитами, окружающими слой эндокардиальных клеток, когда они не могут сохранить клеточную адгезию из-за того, что сердце начинает перекачивать кровь. В результате сердечный тракт оттока будет заблокирован, вызывая сердечное набухание. Экспрессия различных типов кадгеринов в клетках варьируется в зависимости от специфической дифференцировки и спецификации организма во время развития. Кадгерины играют жизненно важную роль в миграции клеток через эпителиально-мезенхимальный переход (EMT) , который требует, чтобы кадгерины образовывали адгезивные соединения с соседними клетками. В клетках нервного гребня, которые являются временными клетками, которые возникают в развивающемся организме во время гаструляции и функционируют в формировании паттерна плана тела позвоночных, кадгерины необходимы для обеспечения миграции клеток с образованием тканей или органов. Кроме того, было показано, что кадгерины, которые ответственны за событие EMT на раннем этапе развития, имеют решающее значение для перепрограммирования определенных взрослых клеток в плюрипотентное состояние, формируя индуцированные плюрипотентные стволовые клетки (iPSC).
После развития кадгерины играют роль в поддержании структуры клеток и тканей, а также в клеточном движении. Регуляция экспрессии кадгерина может происходить посредством метилирования промотора среди других эпигенетических механизмов.
Метастазирование опухоли
Комплекс E-кадгерин-катенин играет ключевую роль в клеточной адгезии; потеря этой функции была связана с повышенной инвазивностью и метастазированием опухолей. Подавление экспрессии E-кадгерина рассматривается как одно из основных молекулярных событий, ответственных за дисфункцию межклеточной адгезии, которая может привести к локальной инвазии и, в конечном итоге, к развитию опухоли. Поскольку E-кадгерины играют важную роль в подавлении опухоли, их также называют «супрессорами инвазии».
Связь с раком
Было обнаружено, что кадгерины и другие дополнительные факторы коррелируют с образованием и ростом некоторых видов рака и тем, как опухоль продолжает расти. Е-кадгерины, известные как эпителиальные кадгерины, находятся на поверхности одной клетки и могут связываться с такими же кадгеринами на другой, образуя мостики. Потеря молекул клеточной адгезии, E-кадгеринов, причинно участвует в формировании эпителиальных типов рака, таких как карциномы. Изменения в любых типах экспрессии кадгерина могут не только контролировать адгезию опухолевых клеток, но также могут влиять на передачу сигнала, что приводит к неконтролируемому росту раковых клеток.
При раке эпителиальных клеток нарушение адгезии клеток к клеткам может привести к развитию вторичных злокачественных новообразований; они удалены от первичного очага рака и могут быть результатом аномалий экспрессии E-кадгеринов или связанных с ним катенинов . САМ, такие как гликопротеины кадгерина, которые обычно действуют как клей и удерживают клетки вместе, действуют как важные медиаторы межклеточных взаимодействий. E-кадгерины на поверхности всех эпителиальных клеток связаны с актиновым цитоскелетом посредством взаимодействия с катенинами в цитоплазме. Таким образом, прикрепленные к цитоскелету, E-кадгерины на поверхности одной клетки могут связываться с таковыми на другой, образуя мостики. При раке эпителиальных клеток нарушение клеточно-клеточной адгезии, которое может приводить к метастазам, может быть результатом аномалий экспрессии E-кадгерина или связанных с ним катенинов .
Связь с эндометрием и эмбриогенезом
Это семейство гликопротеинов отвечает за кальций-зависимый механизм внутриклеточной адгезии. E-кадгерины имеют решающее значение в эмбриогенезе во время нескольких процессов, включая гаструляцию, нейруляцию и органогенез. Кроме того, подавление E-кадгеринов ухудшает внутриклеточную адгезию. Уровни этих молекул повышаются во время лютеиновой фазы, в то время как их экспрессия регулируется прогестероном с кальцитонином эндометрия.
Типы
| Кадгериновый домен (повтор) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
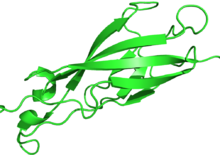
| |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Кадгерин | ||||||||
| Pfam | PF00028 | ||||||||
| ИнтерПро | IPR002126 | ||||||||
| УМНЫЙ | CA | ||||||||
| ПРОФИЛЬ | PDOC00205 | ||||||||
| SCOP2 | 1nci / SCOPe / SUPFAM | ||||||||
| Мембранома | 114 | ||||||||
| |||||||||
| См. Pfam CL0159 для других семейств Cadherin . | |||||||||
Говорят, что у позвоночных встречается более 100 различных типов кадгеринов, которые можно разделить на четыре группы: классические, десмосомальные, протокадгерины и нетрадиционные. Такое большое разнообразие достигается за счет сочетания нескольких генов, кодирующих кадгерин, с альтернативными механизмами сплайсинга РНК. Беспозвоночные содержат менее 20 типов кадгеринов.
Классический
Различные члены семейства кадгеринов находятся в разных местах.
- CDH1 - E-кадгерин (эпителиальный): E-кадгерины обнаруживаются в эпителиальной ткани; не путать с белком-активатором APC / C CDH1 .
- CDH2 - N-кадгерин (нейронный): N-кадгерины обнаружены в нейронах.
- CDH12 - кадгерин 12, тип 2 (N-кадгерин 2)
- CDH3 - Р-кадгерин (плацентарный): Р-кадгерины обнаруживаются в плаценте.
Десмосомальный
- Десмоглеин ( DSG1 , DSG2 , DSG3 , DSG4 )
- Desmocollin ( DSC1 , DSC2 , DSC3 )
Протокадгерины
Протокадгерины являются крупнейшей подгруппой млекопитающих в суперсемействе кадгеринов гомофильных белков клеточной адгезии.
- PCDH1
- PCDH7
- PCDH8
- PCDH9
- PCDH10
- PCDH11X / 11Y
- PCDH12
- PCDH15
- PCDH17
- PCDH18
- PCDH19
- PCDH20
- PCDHA1
- PCDHA2
- PCDHA3
- PCDHA4
- PCDHA5
- PCDHA6
- PCDHA7
- PCDHA8
- PCDHA9
- PCDHA10
- PCDHA11
- PCDHA12
- PCDHA13
- PCDHAC1
- PCDHAC2
- PCDHB1
- PCDHB2
- PCDHB3
- PCDHB4
- PCDHB5
- PCDHB6
- PCDHB7
- PCDHB8
- PCDHB9
- PCDHB10
- PCDHB11
- PCDHB12
- PCDHB13
- PCDHB14
- PCDHB15
- PCDHB16
- PCDHB17
- PCDHB18
- PCDHGA1
- PCDHGA2
- PCDHGA3
- PCDHGA4
- PCDHGA5
- PCDHGA6
- PCDHGA7
- PCDHGA8
- PCDHGA9
- PCDHGA10
- PCDHGA11
- PCDHGA12
- PCDHGB1
- PCDHGB2
- PCDHGB3
- PCDHGB4
- PCDHGB5
- PCDHGB6
- PCDHGB7
- PCDHGC3
- PCDHGC4
- PCDHGC5
- ТОЛСТЫЙ
- FAT2
- FAT4
Нетрадиционные / несгруппированные
- CDH4 - R-кадгерин (сетчатка)
- CDH5 - VE-кадгерин (эндотелий сосудов)
- CDH6 - К-кадгерин (почки)
- CDH7 - кадгерин 7, тип 2
- CDH8 - кадгерин 8, тип 2
- CDH9 - кадгерин 9, тип 2 (Т1-кадгерин)
- CDH10 - кадгерин 10, тип 2 (Т2-кадгерин)
- CDH11 - OB-кадгерин (остеобласт)
- CDH13 - Т-кадгерин - H-кадгерин (сердце)
- CDH15 - М-кадгерин (миотубула)
- CDH16 - KSP-кадгерин
- CDH17 - LI кадгерин (печень-кишечник)
- CDH18 - кадгерин 18, тип 2
- CDH19 - кадгерин 19, тип 2
- CDH20 - кадгерин 20, тип 2
- CDH23 - кадгерин 23 (нейросенсорный эпителий)
- CDH22 , CDH24 , CDH26 , CDH28
- CELSR1 , CELSR2 , CELSR3
- CLSTN1 , CLSTN2 , CLSTN3
- DCHS1 , DCHS2 ,
- LOC389118
- PCLKC
- RESDA1
- RET
Смотрите также
использованная литература
дальнейшее чтение
- Beavon IR (август 2000 г.). «Комплекс E-кадгерин-катенин в метастазах опухоли: структура, функция и регуляция». Европейский журнал рака . 36 (13 Спец. №): 1607–20. DOI : 10.1016 / S0959-8049 (00) 00158-1 . PMID 10959047 .
- Berx G, Becker KF, Höfler H, van Roy F (1998). «Мутации гена Е-кадгерина человека (CDH1)» . Мутация человека . 12 (4): 226–37. DOI : 10.1002 / (SICI) 1098-1004 (1998) 12: 4 <226 :: AID-HUMU2> 3.0.CO; 2-D . PMID 9744472 .
- Брайант Д.М., Стоу Д.Л. (август 2004 г.). «Тонкости торговли электронным кадгерином». Тенденции в клеточной биологии . 14 (8): 427–34. DOI : 10.1016 / j.tcb.2004.07.007 . PMID 15308209 .
- Чун Ю.С., Линдор Н.М., Смирк Т.С., Петерсен Б.Т., Бургарт Л.Дж., Гилфорд П.Дж., Донохью Дж.Х. (июль 2001 г.). «Мутации гена E-кадгерина зародышевой линии: показана ли профилактическая тотальная гастрэктомия?». Рак . 92 (1): 181–7. DOI : 10.1002 / 1097-0142 (20010701) 92: 1 <181 :: АИД-CNCR1307> 3.0.CO; 2-J . PMID 11443625 .
- Георголиос А., Батистату А., Манолопулос Л., Харалабопулос К. (март 2006 г.). «Роль и паттерны экспрессии E-кадгерина в плоскоклеточной карциноме головы и шеи (HNSCC)». Журнал экспериментальных и клинических исследований рака . 25 (1): 5–14. PMID 16761612 .
- Хазан РБ, Цяо Р., Керен Р., Бадано И., Суяма К. (апрель 2004 г.). «Кадгериновый переключатель в прогрессии опухоли». Летопись Нью-Йоркской академии наук . 1014 (1): 155–63. Bibcode : 2004NYASA1014..155H . DOI : 10.1196 / annals.1294.016 . PMID 15153430 . S2CID 37486403 .
- Моран С.Дж., Джойс М., МакАнена О.Дж. (апрель 2005 г.). «CDH1-ассоциированный рак желудка: отчет семьи и обзор литературы». Европейский журнал хирургической онкологии . 31 (3): 259–64. DOI : 10.1016 / j.ejso.2004.12.010 . PMID 15780560 .
- Рейнольдс А.Б., Карнахан Р.Х. (декабрь 2004 г.). «Регулирование стабильности и оборота кадгерина с помощью p120ctn: последствия для болезней и рака». Семинары по клеточной биологии и биологии развития . 15 (6): 657–63. DOI : 10.1016 / j.semcdb.2004.09.003 . PMID 15561585 .
- Ван HD, Рен Дж, Чжан Л. (ноябрь 2004 г.). «Мутация зародышевой линии CDH1 при наследственной карциноме желудка» . Всемирный журнал гастроэнтерологии . 10 (21): 3088–93. DOI : 10,3748 / wjg.v10.i21.3088 . PMC 4611247 . PMID 15457549 .
- Wijnhoven BP, Dinjens WN, Pignatelli M (август 2000 г.). «Комплекс клеточной адгезии E-кадгерин-катенин и рак человека» . Британский журнал хирургии . 87 (8): 992–1005. DOI : 10.1046 / j.1365-2168.2000.01513.x . hdl : 1765/56571 . PMID 10931041 . S2CID 3083613 .
- Wilson PD (апрель 2001 г.). «Полицистин: новые аспекты структуры, функции и регуляции». Журнал Американского общества нефрологов . 12 (4): 834–45. DOI : 10,1681 / ASN.V124834 . PMID 11274246 .
- Рено-Янг М., Галлин В.Дж. (октябрь 2002 г.). «В первом внеклеточном домене E-кадгерина для адгезии необходимы гетерофильные взаимодействия, но не консервативный мотив His-Ala-Val» . Журнал биологической химии . 277 (42): 39609–16. DOI : 10.1074 / jbc.M201256200 . PMID 12154084 .
- Зайдель-Бар Р. (январь 2013 г.). «Кадгерин адгезивный с первого взгляда» . Журнал клеточной науки . 126 (Pt 2): 373–8. DOI : 10,1242 / jcs.111559 . PMID 23547085 .
- Хмеларова М., Баранова И., Рузова Е., Лако Дж., Хрохова К., Дворакова Е., Палицкая В. (октябрь 2019 г.). «Важность метилирования кадгеринов при раке яичников: подход к секвенированию следующего поколения». Патология и онкологические исследования . 25 (4): 1457–1465. DOI : 10.1007 / s12253-018-0500-у . PMID 30368729 . S2CID 53083365 .
- Daw S, Law S (февраль 2021 г.). «Функциональное взаимодействие факторов транскрипции и молекул клеточной адгезии в экспериментальной миелодисплазии, включая компартмент гематопоэтического ствола-предшественника». Молекулярная и клеточная биохимия . 476 (2): 535–551. DOI : 10.1007 / s11010-020-03920-6 . PMID 33011884 . S2CID 222153001 .
- Священник А.В., Коирала Р., Сивасанкар С. (декабрь 2019 г.). «Одномолекулярные исследования адгезии классического и десмосомального кадгерина» . Текущее мнение в области биомедицинской инженерии . 12 : 43–50. DOI : 10.1016 / j.cobme.2019.08.006 . PMC 6859941 . PMID 31742239 .
- Аду-Гьямфи Е.А., Чика А., Горлеку П.Н., Уллах А., Панхвар З., Руан Л.Л., Дин Й.Б., Ван YX (февраль 2021 г.). «Участие молекул клеточной адгезии, плотных и щелевых соединений в плацентации человека» . Репродуктивные науки (Таузенд-Оукс, Калифорния) . 28 (2): 305–320. DOI : 10.1007 / s43032-020-00364-7 . PMID 33146876 .
внешние ссылки
- Proteopedia Cadherin - вид кадхерина структура в интерактивном 3D
- Домен Cadherin на ПРОЗИТЕ
- Семья кадгеринов
- Ресурс кадгерина
- ИнтерПро : IPR002126
- [1]



