Уравнение Ван 'т Гоффа - Van 't Hoff equation
В Гофф уравнение Ван» относится изменение равновесной константа , K э , химическая реакция на изменение температуры , T , учитывая стандартное изменение энтальпии , Δ г Н ⊖ , для процесса. Он был предложен голландским химиком Якобусом Хенрикусом ван 'т-Хоффом в 1884 году в его книге Études de Dynamique chimique ( Исследования в области динамической химии ).
Уравнение Ван 'т-Гоффа широко используется для исследования изменений функций состояния в термодинамической системе . В Van «т Хофф участок , который является производным от этого уравнения, является особенно эффективным при оценке изменения энтальпии и энтропии в виде химической реакции .
Уравнение
Резюме и использование
Стандартное давление , используется для определения опорного состояния для т уравнения Хоффа фургона», который является
где ln обозначает натуральный логарифм , - константа термодинамического равновесия , а R - постоянная идеального газа . Это уравнение является точным при любой одной температуре и всех давлениях, полученное из требования, чтобы свободная энергия Гиббса реакции была стационарной в состоянии химического равновесия .
На практике уравнение часто интегрируют между двумя температурами в предположении, что стандартная энтальпия реакции постоянна (и, кроме того, она также часто считается равной ее значению при стандартной температуре ). Поскольку на самом деле стандартная энтропия реакции зависит от температуры для большинства процессов, интегральное уравнение является только приближенным. На практике также производятся аппроксимации коэффициентов активности в пределах константы равновесия.
Основное использование интегрированного уравнения - оценка новой константы равновесия при новой абсолютной температуре, предполагающей постоянное стандартное изменение энтальпии во всем температурном диапазоне. Чтобы получить интегральное уравнение, удобно сначала переписать уравнение Ван 'т Гоффа в виде
Тогда определенный интеграл между температурами T 1 и T 2 равен
В этом уравнении K 1 - константа равновесия при абсолютной температуре T 1 , а K 2 - константа равновесия при абсолютной температуре T 2 .
Развитие из термодинамики
Комбинируя известную формулу для свободной энергии Гиббса реакции
где S - энтропия системы, с уравнением изотермы свободной энергии Гиббса:
мы получаем
Дифференцирование этого выражения по переменной T , предполагая, что оба и не зависят от T, дает уравнение Ван 'т-Гоффа. Ожидается, что эти предположения несколько нарушатся при больших колебаниях температуры.
При условии, что и постоянны, предыдущее уравнение дает ln K как линейную функцию от 1/Ти поэтому известна как линейная форма уравнения Ван 'т Гоффа. Следовательно, когда диапазон температур достаточно мал, чтобы стандартная энтальпия реакции и энтропия реакции были по существу постоянными, график натурального логарифма константы равновесия в зависимости от обратной температуры дает прямую линию. Наклон линии можно умножить на газовую постоянную R, чтобы получить стандартное изменение энтальпии реакции, а точку пересечения можно умножить на R, чтобы получить стандартное изменение энтропии .
Изотерма Ван 'т Гоффа
Ван «т Хофф изотерма может быть использован для определения температурных зависимости свободной энергии Гиббса реакции для нестандартного состояния реакций при температуре постоянной:
где - свободная энергия Гиббса реакции в нестандартных состояниях при температуре , - свободная энергия Гиббса для реакции при , - степень реакции , а Q r - термодинамический коэффициент реакции . Так , температурная зависимость обоих слагаемых можно описать с помощью уравнений Ван t'Hoff как функцию Т . Это находит применение в области электрохимии . особенно при изучении температурной зависимости гальванических элементов.
Изотерма также может использоваться при фиксированной температуре для описания закона действия массы . Когда реакция находится в равновесии , Q r = K экв и . В противном случае изотерма Ван 'т-Гоффа предсказывает направление, которое система должна сместить, чтобы достичь равновесия; когда Δ r G <0 , реакция движется в прямом направлении, тогда как при Δ r G > 0 реакция движется в обратном направлении. См. Химическое равновесие .
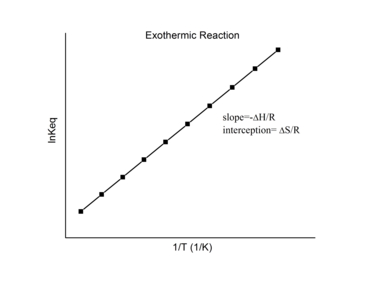
Сюжет Ван 'т Хоффа
Для обратимой реакции константу равновесия можно измерить при различных температурах. Эти данные могут быть нанесены на график с ln K eq по оси y и1/Тпо оси x . Данные должны иметь линейную зависимость, уравнение для которой может быть найдено путем аппроксимации данных с использованием линейной формы уравнения Ван 'т-Гоффа.
Этот график называется «Ван«Гофф сюжет»и широко используется для оценки энтальпии и энтропии из химической реакции . Из этого сюжета -Δ r H/р наклон, а Δ r S/р является точкой пересечения линейной посадки.
Путь измерения равновесной константы , K э , при различных температурах, Ван - Гофф «т участок может быть использован для оценки реакции при изменении температуры. Зная наклон и точку пересечения графика Ван 'т-Гоффа, энтальпию и энтропию реакции можно легко получить, используя
График Ван 'т Гоффа можно использовать для быстрого определения энтальпии химической реакции как качественно, так и количественно. Это изменение энтальпии может быть положительным или отрицательным, что приводит к двум основным формам графика Ван 'т Гоффа.
Эндотермические реакции
Для эндотермической реакции тепло поглощается, что делает изменение чистой энтальпии положительным. Таким образом, согласно определению уклона:
Когда реакция эндотермическая , Δ r H > 0 (и газовая постоянная R > 0 ), поэтому
Таким образом, для эндотермической реакции график Ван 'т Гоффа всегда должен иметь отрицательный наклон.
Экзотермические реакции
При экзотермической реакции выделяется тепло, в результате чего суммарное изменение энтальпии становится отрицательным. Таким образом, согласно определению уклона:
Для экзотермической реакции Δ r H <0 , поэтому
Таким образом, для экзотермической реакции график Ван 'т Гоффа всегда должен иметь положительный наклон.
Распространение ошибки
На первый взгляд, используя тот факт, что Δ r G ⊖ = - RT ln K = Δ r H ⊖ - T Δ r S ⊖, может показаться, что двух измерений K будет достаточно, чтобы получить точное значение Δ_r H ⊖ :
где K 1 и K 2 - значения констант равновесия, полученные при температурах T 1 и T 2 соответственно. Однако точность значений Δ r H ⊖, полученных таким образом, сильно зависит от точности измеренных значений константы равновесия.
Использование распространения ошибки показывает, что ошибка в Δ r H ⊖ будет примерно в 76 кДж / моль, умноженная на экспериментальную неопределенность (ln K 1 - ln K 2 ) , или примерно в 110 кДж / моль, умноженную на неопределенность в значениях ln K. . Аналогичные соображения применимы к энтропии реакции, полученной из Δ r S ⊖ =1/Т(Δ H ⊖ + RT ln K ) .
Следует отметить, что когда константы равновесия измерены в трех или более температурах, значения Д г H ⊖ и Д г S ⊖ часто получают с помощью прямой линии фитинга . Ожидается, что с помощью этой процедуры ошибка будет уменьшена, хотя предположение, что энтальпия и энтропия реакции постоянны, может оказаться верным, а может и не оказаться. Если существует значительная температурная зависимость одной или обеих величин, она должна проявляться в нелинейном поведении на графике Ван-Хоффа; однако, по-видимому, потребуется более трех точек данных, чтобы наблюдать это.
Применение сюжета Ван 'т Хоффа
Анализ Ван 'т Гоффа
В биологических исследованиях график Ван'т-Хоффа также называется анализом Ван'т-Хоффа. Это наиболее эффективно для определения предпочтительного продукта в реакции.
Предположим, что в реакции образуются два продукта B и C:
- a A + d D → b B,
- a A + d D → c C.
В этом случае K eq можно определить как отношение B к C, а не как константу равновесия.
Когда B/C > 1, B - предпочтительный продукт, и данные на графике Ван 'т Хоффа будут в положительной области.
Когда B/C <1, C - предпочтительный продукт, и данные на графике Ван 'т Хоффа будут в отрицательной области.
Используя эту информацию, анализ Ван 'т Гоффа может помочь определить наиболее подходящую температуру для предпочтительного продукта.
В 2010 году Ван «т анализ Hoff был использован , чтобы определить , является ли , предпочтительно , образует воду в водородную связь с C -terminus или N -terminus из аминокислоты пролина. Константа равновесия для каждой реакции была найдена при различных температурах, и был построен график Ван 'т Гоффа. Этот анализ показал, что энтальпийно вода предпочитает водородную связь с С- концом, но энтропийно она более предпочтительна для водородной связи с N- концом. В частности, они обнаружили, что водородным связям на С- конце способствует 4,2–6,4 кДж / моль. В N -terminus связывание водорода благоприятствует 31-43 Дж / (К моль).
Сами по себе эти данные не могли сделать вывод, с каким участком вода будет предпочтительно водородной связью, поэтому были использованы дополнительные эксперименты. Было определено, что при более низких температурах предпочтительны энтальпийно предпочтительные частицы, вода, связанная водородными связями с С- концом. При более высоких температурах предпочтение отдавалось энтропийно предпочтительным веществам, водородной связью воды с N- концом.
Механистические исследования
Химическая реакция может иметь разные механизмы реакции при разных температурах.
В этом случае можно использовать график Ван 'т-Гоффа с двумя или более линейными аппроксимациями. Каждая линейная аппроксимация имеет различный наклон и точку пересечения, что указывает на разные изменения энтальпии и энтропии для каждого отдельного механизма. График Ван 'т-Хоффа можно использовать для определения изменения энтальпии и энтропии для каждого механизма и предпочтительного механизма при различных температурах.
На рисунке в качестве примера реакция протекает по механизму 1 при высокой температуре и по механизму 2 при низкой температуре.
Температурная зависимость
График Ван 'т-Хоффа является линейным, исходя из негласного предположения, что энтальпия и энтропия постоянны при изменении температуры. Однако в некоторых случаях энтальпия и энтропия резко меняются с температурой. Приближение первого порядка предполагает, что два разных продукта реакции имеют разную теплоемкость. Включение этого предположения дает дополнительный членc/Т 2в выражении для константы равновесия как функции температуры. Затем можно использовать полиномиальную аппроксимацию для анализа данных, которые демонстрируют непостоянную стандартную энтальпию реакции:
куда
Таким образом, энтальпию и энтропию реакции можно определить при определенных температурах, даже если существует температурная зависимость.
Самостоятельная сборка ПАВ
Соотношение Ван 'т-Гоффа особенно полезно для определения энтальпии мицеллообразования Δ H⊖
миз поверхностно -активных веществ от температурной зависимости концентрации критических мицелл (CMC):
Однако это отношение теряет свою силу, когда число агрегации также зависит от температуры, и вместо этого следует использовать следующее соотношение:
где G N + 1 и G N представляют собой свободные энергии поверхностно-активного вещества в мицелле с числом агрегации N + 1 и N соответственно. Этот эффект особенно актуален для неионных этоксилированных поверхностно-активных веществ или блок-сополимеров полиоксипропилена и полиоксиэтилена (полоксамеры, плюроники, синпероники). Расширенное уравнение можно использовать для извлечения числа агрегации самоорганизованных мицелл из дифференциальных сканирующих калориметрических термограмм.
Смотрите также
- Соотношение Клаузиуса – Клапейрона
- Фактор Ван 'т Гоффа ( i )
- Уравнение Гиббса – Гельмгольца.
- Равновесие растворимости



























![{\ displaystyle {\ begin {align} \ Delta _ {r} H_ {1} & = - R \ times {\ text {slope}} _ {1}, & \ Delta _ {r} S_ {1} & = R \ times {\ text {intercept}} _ {1}; \\ [5pt] \ Delta _ {r} H_ {2} & = - R \ times {\ text {slope}} _ {2}, & \ Дельта _ {r} S_ {2} & = R \ times {\ text {intercept}} _ {2}. \ End {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b7e4e668b82b9ee277ed6bf1aaae55cb12f15a8)




