Миниген - Minigene
Миниген представляет собой минимальный фрагмент гена , который включает в себя экзон и регуляторные области , необходимый для гена , чтобы выразить себя таким же образом , как дикий тип фрагмент гена. Это миниген в самом простом смысле. Можно сконструировать более сложные минигены, содержащие несколько экзонов и интрон (ы) . Минигены представляют собой ценный инструмент для исследователей, оценивающих паттерны сплайсинга как in vivo, так и in vitro в биохимических экспериментах. В частности, минигены используются в качестве репортерных векторов сплайсинга (также называемых векторами захвата экзонов ) и действуют как зонд, чтобы определить, какие факторы важны для результатов сплайсинга. Их можно сконструировать для проверки того, как цис-регуляторные элементы (эффекты РНК) и транс-регуляторные элементы (ассоциированные белки / факторы сплайсинга ) влияют на экспрессию генов.
История
Минигены впервые были описаны как соматическая сборка сегментов ДНК и состояла из областей ДНК, которые, как известно, кодируют белок, и фланкирующих областей, необходимых для экспрессии белка. Этот термин впервые был использован в статье 1977 года для описания клонирования двух минигенов, которые были разработаны для экспрессии пептида.
Сплайсинг РНК был открыт в конце 1970-х годов в результате изучения аденовирусов, которые проникают в млекопитающих и размножаются внутри них. Исследователи идентифицировали молекулы РНК, содержащие последовательности из несмежных частей генома вируса. Это открытие привело к выводу о существовании регуляторных механизмов, влияющих на зрелую РНК и гены, которые она экспрессирует. Использование минигенов в качестве вектора, сообщающего о сплайсинге, для изучения эффектов регуляции сплайсинга РНК естественным образом последовало и остается основным применением минигенов на сегодняшний день.
Типы
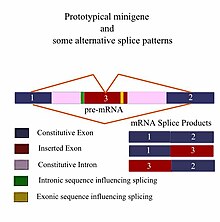
Чтобы обеспечить хорошую модель минигена, фрагмент гена должен иметь все необходимые элементы, чтобы гарантировать, что он демонстрирует те же паттерны альтернативного сплайсинга (AS) , что и ген дикого типа , т. Е. Длина фрагмента должна включать все расположенные выше и ниже по течению. последовательности, которые могут повлиять на его сращивание. Таким образом, большинство минигенных проектов начинается с тщательного анализа требований эксперимента in silico перед проведением любой «мокрой» лабораторной работы. С появлением биоинформатики и повсеместного использования компьютеров в настоящее время существует несколько хороших программ для идентификации цис-действующих контролирующих областей, которые влияют на результаты сплайсинга гена, а расширенные программы могут даже учитывать результаты сплайсинга в различных типах тканей. Различия в минигенах обычно отражаются в конечном размере фрагмента, который, в свою очередь, является отражением сложности самого минигена. Количество чужеродных элементов ДНК (экзонов и интронов), вставленных в конститутивные экзоны и интроны данного фрагмента, зависит от типа эксперимента и запрашиваемой информации. Типичный эксперимент может включать минигены дикого типа, которые, как ожидается, будут нормально экспрессировать гены в сравнительном прогоне с генно-инженерными аллельными вариациями, которые заменяют ген дикого типа и были клонированы в те же фланкирующие последовательности, что и исходный фрагмент. Эти типы экспериментов помогают определить влияние различных мутаций на сплайсинг пре-мРНК .
Строительство
После выбора подходящего геномного фрагмента (этап 1) экзоны и интроны фрагмента могут быть вставлены и амплифицированы вместе с фланкирующими конститутивными экзонами и интронами исходного гена с помощью ПЦР . Праймеры для ПЦР можно выбрать так, чтобы они оставляли « липкие концы » на 3'-смысловой и антисмысловой цепях (этап 2). Эти «липкие концы» могут быть легко включены в вектор TOPO путем лигирования в коммерчески доступный источник, к которому уже прикреплена лигаза на момент включения (стадия 3). Последующие векторы TOPO можно трансфицировать в клетки E.coli (этап 4). После инкубации общую РНК можно выделить из бактериальных колоний и проанализировать с помощью ОТ-ПЦР для количественной оценки соотношений включения / исключения экзонов (этап 5). Миниген можно трансфицировать в разные типы клеток с различными факторами сплайсинга для тестирования транс-действующих элементов (этап 6). Экспрессированные гены или кодируемые ими белки можно анализировать для оценки компонентов сплайсинга и их эффектов с помощью различных методов, включая гибридизацию или эксклюзионную хроматографию .
Использует
Ошибки сплайсинга РНК , по оценкам, возникают в трети генетических заболеваний. Чтобы понять патогенез и идентифицировать потенциальные цели терапевтического вмешательства при этих заболеваниях, очень важно объяснить вовлеченные элементы сплайсинга. Определение полного набора компонентов, участвующих в сплайсинге, представляет множество проблем из-за обилия альтернативного сплайсинга, который встречается в большинстве генов человека, и специфичности, при которой сплайсинг осуществляется in vivo . Сплайсинг четко проводится от типа клетки к типу клетки и на разных стадиях клеточного развития. Следовательно, очень важно, чтобы любые предположения in vitro или биоинформатики о регуляции сплайсинга подтверждались in vivo . Минигены используются для выяснения цис- регуляторных элементов, транс- регуляторных элементов и других регуляторов сплайсинга преждевременной РНК in vivo . Минигены применялись для изучения разнообразных генетических заболеваний из-за вышеупомянутого обилия альтернативно сплайсированных генов, а также специфичности и вариабельности, наблюдаемых в регуляции сплайсинга. Ниже приведены примеры использования минигена при различных заболеваниях. Хотя это не исчерпывающий список, он дает лучшее понимание того, как используются минигены.
Эндокринные заболевания
Ошибки сплайсинга РНК могут иметь решающее влияние на функционирование белков, в том числе гормонов, секретируемых эндокринной системой . Эти эффекты на гормоны были определены как причина многих эндокринных нарушений, включая патологические состояния, связанные с щитовидной железой, рахит , гиперинсулинемическую гипогликемию и врожденную гиперплазию надпочечников . Одним из конкретных примеров ошибки сплайсинга, вызывающей эндокринное заболевание, которое было изучено с использованием минигенов, является тип дефицита гормона роста, называемый изолированным дефицитом гормона роста (IGHD), заболевание, которое приводит к задержке роста. IGHD типа II представляет собой аутосомно-доминантную форму, вызванную мутацией в промежуточной последовательности (IVS), прилегающей к экзону 3 гена, кодирующего гормон роста 1, гена GH-1. Эта мутированная форма IVS3 вызывает пропуск экзона 3 в продукте мРНК. МРНК (-E3) кодирует усеченную форму hGH, которая затем подавляет нормальную секрецию hGH. Минигены были использованы для определения того, что точечная мутация внутри интронного энхансера сплайсинга (ISE), встроенного в IVS3, была виновата в пропуске E3. Более того, было определено, что на функцию ISE влияет близлежащий сменный элемент переменного тока , что свидетельствует о том, что эта конкретная ошибка сращивания вызвана транс-действующим фактором.
Нейродегенеративные заболевания
Накопление тау-белка связано с нейродегенеративными заболеваниями, включая болезни Альцгеймера и Паркинсона, а также с другими таупатиями . Изоформы тау-белка создаются путем альтернативного сплайсинга экзонов 2, 3 и 10. Регуляция сплайсинга тау специфична для стадии развития, физиологии и местоположения. Ошибки при сплайсинге тау-белка могут возникать как в экзонах, так и в интронах и, в зависимости от ошибки, приводить к изменениям структуры белка или потере функции. Агрегация этих аномальных тау-белков напрямую коррелирует с патогенезом и прогрессированием заболевания. Минигены использовались несколькими исследователями, чтобы помочь понять регуляторные компоненты, ответственные за сплайсинг мРНК гена TAU.
Рак
Рак - сложное разнородное заболевание, которое может быть наследственным или возникать в результате воздействия окружающей среды. Минигены используются, чтобы помочь онкологам понять роль сплайсинга пре-мРНК в различных типах рака. Особый интерес представляют специфичные для рака генетические мутации, которые нарушают нормальные процессы сплайсинга, включая те, которые влияют на компоненты сплайсосом и РНК-связывающие белки, такие как гетерогенные ядерные рибонуклеопочастицы (hnRNP) , белки, богатые серином / аргинином (SR) и малые рибонуклеопротеины (snRNP) . Белки, кодируемые аберрантно сплайсированными пре-мРНК, функционально различны и вносят свой вклад в характерные аномалии, проявляемые раковыми клетками, включая их способность пролиферировать, вторгаться и подвергаться ангиогенезу и метастазированию. Минигены помогают исследователям идентифицировать генетические мутации при раке, которые приводят к ошибкам сплайсинга, и определять последующие эффекты, которые эти ошибки сплайсинга оказывают на экспрессию генов. Используя знания, полученные в ходе исследований с использованием минигенов, онкологи предложили тесты, предназначенные для обнаружения продуктов аномальной экспрессии генов в диагностических целях. Кроме того, изучается перспектива использования минигенов в качестве иммунотерапии рака .
Смотрите также
использованная литература
дальнейшее чтение
- «Альтернативный сплайсинг пре-мРНК: теория и протоколы», Стефан Штамм, Крис Смит и Рейнхард Люрманн ISBN 978-3527326068
- «Молекулярная диагностика. Второе издание», под ред. Джорджа П. Патриноса и Вильхельма Ансорге ISBN 0123745373
- "ДНК-вакцины" под редакцией Хильдегуна Эртл ISBN 1461349257
- «Альтернативный сплайсинг и болезнь (прогресс в молекулярной и субклеточной биологии)» Филиппа Жантера ISBN 3540344489
внешние ссылки
- Веб-страница Стефана Штамма в Университете Кентукки . Хороший обзор исследований минигена.
- Лаборатория Кристофера Берджа на веб-сайте Массачусетского технологического института . Хороший сайт для теоретического анализа сварки.
- Браузер генома UCSC . Большая база данных для получения информации о генах.

