Геномная библиотека - Genomic library
Геномная библиотека представляет собой набор из общей геномной ДНК из одного организма . ДНК хранится в популяции идентичных векторов , каждый из которых содержит разные вставки ДНК. Чтобы создать геномную библиотеку, ДНК организма извлекается из клеток, а затем переваривается рестрикционным ферментом, чтобы разрезать ДНК на фрагменты определенного размера. Затем фрагменты вставляют в вектор с помощью ДНК-лигазы . Затем векторная ДНК может быть поглощена организмом-хозяином - обычно популяцией Escherichia coli или дрожжей - при этом каждая клетка содержит только одну векторную молекулу. Использование клетки-хозяина для переноса вектора позволяет легко амплифицировать и извлекать определенные клоны из библиотеки для анализа.
Доступно несколько видов векторов с разной емкостью вставки. Как правило, библиотеки, созданные из организмов с более крупными геномами, требуют векторов с более крупными вставками, поэтому для создания библиотеки требуется меньшее количество векторных молекул. Исследователи могут выбрать вектор, также учитывая идеальный размер вставки, чтобы найти желаемое количество клонов, необходимое для полного покрытия генома.
Геномные библиотеки обычно используются для приложений секвенирования . Они сыграли важную роль в секвенировании всего генома нескольких организмов, включая геном человека и несколько модельных организмов .
История
Первая ДНК на основе геном никогда не последователен был достигнут двукратный лауреатом Нобелевской премии, Фредерик Sanger , в 1977 году Sanger и его команда ученых создала библиотеку бактериофага , фи X 174 , для использования в ДНК последовательности . Важность этого успеха способствовала постоянно растущему спросу на секвенирование геномов для исследования генной терапии . Команды теперь могут каталогизировать полиморфизмов в геномах и исследовать эти гены - кандидаты , способствующие недугов , таких как болезнь Паркинсона , болезнь Альцгеймера , рассеянный склероз , ревматоидный артрит и диабет 1 типа . Это связано с продвижением исследований ассоциаций в масштабе всего генома с возможностью создания и секвенирования геномных библиотек. Предыдущие исследования сцеплений и генов-кандидатов были одними из единственных подходов.
Построение геномной библиотеки
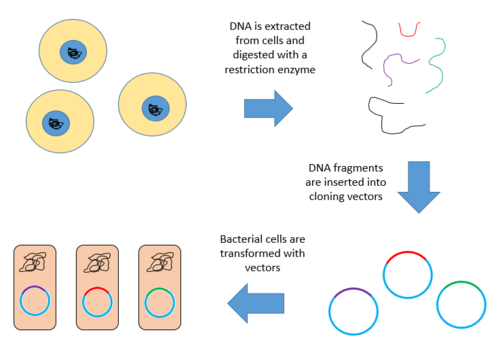
Создание геномной библиотеки включает создание множества рекомбинантных молекул ДНК . Геномная ДНК организма извлекается, а затем переваривается рестрикционным ферментом . Для организмов с очень маленькими геномами (~ 10 т.п.н.) расщепленные фрагменты можно разделить с помощью гель-электрофореза . Затем разделенные фрагменты могут быть вырезаны и клонированы в вектор отдельно. Однако, когда большой геном переваривается рестрикционным ферментом, остается слишком много фрагментов, чтобы вырезать их по отдельности. Весь набор фрагментов должен быть клонирован вместе с вектором, после чего может происходить разделение клонов. В любом случае фрагменты лигируют в вектор, который был расщеплен тем же рестрикционным ферментом. Затем вектор, содержащий встроенные фрагменты геномной ДНК, может быть введен в организм-хозяин.
Ниже приведены шаги по созданию геномной библиотеки из большого генома.
- Извлечь и очистить ДНК.
- Расщепляйте ДНК рестрикционным ферментом. Это создает фрагменты одинакового размера, каждый из которых содержит один или несколько генов.
- Вставьте фрагменты ДНК в векторы, которые были разрезаны тем же рестрикционным ферментом. Используйте ферментную ДНК-лигазу, чтобы запечатать фрагменты ДНК в векторе. Это создает большой пул рекомбинантных молекул.
- Эти рекомбинантные молекулы поглощаются бактерией-хозяином путем трансформации , создавая библиотеку ДНК.
Ниже представлена схема описанных выше шагов.
Определение титра библиотеки
После создания геномной библиотеки с использованием вирусного вектора, такого как фаг лямбда , можно определить титр библиотеки. Расчет титра позволяет исследователям приблизительно определить, сколько инфекционных вирусных частиц было успешно создано в библиотеке. Для этого используются разведения библиотеки для трансформации культур E. coli известных концентраций. Затем культуры высевают на чашки с агаром и инкубируют в течение ночи. Подсчитывают количество вирусных бляшек , и их можно использовать для расчета общего количества инфекционных вирусных частиц в библиотеке. Большинство вирусных векторов также несут маркер, который позволяет отличать клоны, содержащие вставку, от тех, которые не имеют вставки. Это позволяет исследователям также определить процент инфекционных вирусных частиц, фактически несущих фрагмент библиотеки.
Аналогичный метод можно использовать для титрования геномных библиотек, созданных с использованием невирусных векторов, таких как плазмиды и ВАС . Тестовое лигирование библиотеки можно использовать для трансформации E. coli. Затем трансформацию наносят на чашки с агаром и инкубируют в течение ночи. Титр трансформации определяют путем подсчета количества колоний, присутствующих на чашках. Эти векторы обычно имеют селективный маркер, позволяющий дифференцировать клоны, содержащие вставку, от клонов, которые не содержат. Выполняя этот тест, исследователи также могут определить эффективность лигирования и внести необходимые корректировки, чтобы гарантировать получение желаемого количества клонов для библиотеки.
Библиотека скрининга
Чтобы изолировать клоны, содержащие интересующие области, из библиотеки, библиотека должна быть сначала подвергнута скринингу . Один из методов скрининга - гибридизация . Каждая трансформированная клетка-хозяин библиотеки будет содержать только один вектор с одной вставкой ДНК. Всю библиотеку можно поместить на фильтр поверх носителя . Фильтр и колонии готовят для гибридизации, а затем метят зондом . Целевая ДНК-вставка, представляющая интерес, может быть идентифицирована с помощью обнаружения, такого как авторадиография, из-за гибридизации с зондом, как показано ниже.
Другой метод скрининга - полимеразная цепная реакция (ПЦР). Некоторые библиотеки хранятся в виде пулов клонов, и скрининг с помощью ПЦР является эффективным способом идентификации пулов, содержащих определенные клоны.
Типы векторов
Размер генома варьируется у разных организмов, и вектор клонирования должен быть выбран соответственно. Для большого генома следует выбирать вектор с большой емкостью, чтобы относительно небольшое количество клонов было достаточным для покрытия всего генома. Однако часто бывает труднее охарактеризовать вставку, содержащуюся в векторе большей емкости.
Ниже приведена таблица нескольких типов векторов, обычно используемых для геномных библиотек, и размеров вставок, которые обычно содержатся в каждом из них.
| Тип вектора | Размер вставки (тысячи баз ) |
|---|---|
| Плазмиды | до 10 |
| Лямбда фага (λ) | до 25 |
| Космиды | до 45 |
| Бактериофаг P1 | От 70 до 100 |
| Искусственные хромосомы P1 (PAC) | 130 к 150 |
| Бактериальные искусственные хромосомы (БАХ) | От 120 до 300 |
| Искусственные хромосомы дрожжей (YAC) | От 250 до 2000 |
Плазмиды
Плазмиду представляет собой двухцепочечную круглую ДНК молекулы обычно используют для молекулярного клонирования . Плазмиды обычно имеют длину от 2 до 4 пар оснований (т.п.н.) и способны нести вставки размером до 15 тыс. Пар оснований. Плазмиды содержат источник репликации, позволяющий им реплицироваться внутри бактерии независимо от хромосомы хозяина . Плазмиды обычно несут ген устойчивости к антибиотикам, который позволяет отобрать бактериальные клетки, содержащие плазмиду. Многие плазмиды также несут репортерный ген, который позволяет исследователям отличать клоны, содержащие вставку, от клонов, в которых ее нет.
Лямбда фага (λ)
Фаг λ - это двухцепочечный ДНК-вирус , поражающий E. coli . Λ-хромосома имеет длину 48,5 КБ и может содержать вставки размером до 25 КБ. Эти вставки заменяют несущественные вирусные последовательности в λ-хромосоме, в то время как гены, необходимые для образования вирусных частиц и инфекции, остаются нетронутыми. Вставка ДНК реплицируется с вирусной ДНК; таким образом, вместе они упакованы в вирусные частицы. Эти частицы очень эффективны при заражении и размножении, что приводит к более высокому производству рекомбинантных λ-хромосом. Однако из-за меньшего размера вставки библиотеки, созданные с фагом λ, могут потребовать много клонов для полного покрытия генома.
Космиды
Космидные векторы - это плазмиды, которые содержат небольшую область ДНК бактериофага λ, называемую cos-последовательностью. Эта последовательность позволяет упаковывать космиду в частицы бактериофага λ. Эти частицы, содержащие линеаризованную космиду, вводятся в клетку-хозяин путем трансдукции . Попав внутрь хозяина, космиды циркулируют с помощью ДНК-лигазы хозяина, а затем функционируют как плазмиды. Космиды могут нести вставки размером до 40 КБ.
Векторы бактериофага P1
Векторы бактериофага P1 могут содержать вставки размером 70–100 килобайт. Они начинаются как линейные молекулы ДНК, упакованные в частицы бактериофага P1. Эти частицы вводят в штамм E. coli, экспрессирующий рекомбиназу Cre . Линейный вектор P1 становится кольцевым путем рекомбинации между двумя сайтами loxP в векторе. Векторы P1 обычно содержат ген устойчивости к антибиотикам и маркер положительной селекции, позволяющий отличать клоны, содержащие вставку, от клонов, которые не содержат. Векторы P1 также содержат репликон плазмиды P1 , что гарантирует присутствие только одной копии вектора в клетке. Однако существует второй репликон P1, называемый литическим репликоном P1, который контролируется индуцибельным промотором . Этот промотор позволяет амплифицировать более одной копии вектора на клетку перед экстракцией ДНК .
Искусственные хромосомы P1
Искусственные хромосомы P1 (PAC) обладают свойствами как векторов P1, так и бактериальных искусственных хромосом (BAC). Подобно векторам P1, они содержат плазмиду и литический репликон, как описано выше. В отличие от векторов P1, их не нужно упаковывать в частицы бактериофага для трансдукции. Вместо этого они вводятся в E. coli в виде кольцевых молекул ДНК посредством электропорации, как и БАС. Также как и BAC, их относительно сложнее приготовить из-за единственной точки начала репликации.
Бактериальные искусственные хромосомы
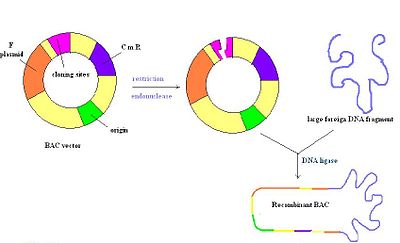
Бактериальные искусственные хромосомы (BAC) представляют собой кольцевые молекулы ДНК, обычно длиной около 7 килобайт, которые могут содержать вставки размером до 300 килобайт. Векторы ВАС содержат репликон, полученный из фактора F E. coli , что обеспечивает их сохранение в одной копии на клетку. После лигирования вставки в ВАС, ВАС вводят в дефектные по рекомбинации штаммы E. coli путем электропорации. Большинство векторов ВАС содержат ген устойчивости к антибиотикам, а также маркер положительной селекции. На рисунке справа изображен вектор ВАС, разрезанный рестрикционным ферментом, с последующей вставкой чужеродной ДНК, которая повторно отжигается лигазой. В целом, это очень стабильный вектор, но их может быть трудно приготовить из-за единственной точки начала репликации, как и PAC.
Искусственные хромосомы дрожжей
Искусственные хромосомы дрожжей (YAC) - это линейные молекулы ДНК, содержащие необходимые характеристики аутентичной хромосомы дрожжей , включая теломеры , центромеру и точку начала репликации . Большие вставки ДНК могут быть лигированы в середину YAC, так что есть «плечо» YAC с обеих сторон вставки. Рекомбинантный YAC вводят в дрожжи путем трансформации; селектируемые маркеры, присутствующие в YAC, позволяют идентифицировать успешные трансформанты. YAC могут содержать вставки размером до 2000 КБ, но большинство библиотек YAC содержат вставки размером 250-400 КБ. Теоретически не существует верхнего предела размера вставки, которую может вместить YAC. Именно качество подготовки ДНК, используемой для вставок, определяет предел размера. Самый сложный аспект использования YAC - это то, что они склонны к перегруппировке .
Как выбрать вектор
Выбор вектора требует, чтобы созданная библиотека была репрезентативной для всего генома. Любая вставка генома, полученная из рестрикционного фермента, должна иметь равные шансы оказаться в библиотеке по сравнению с любой другой вставкой. Кроме того, рекомбинантные молекулы должны содержать достаточно большие вставки, обеспечивающие удобство работы с размером библиотеки. Это, в частности, определяется количеством клонов, которые необходимо иметь в библиотеке. Количество клонов для выборки всех генов определяется размером генома организма, а также средним размером вставки. Это представлено формулой (также известной как формула углерода и Кларка):
куда,
необходимое количество рекомбинантов
это желаемая вероятность того, что любой фрагмент в геноме хотя бы один раз появится в созданной библиотеке.
- дробная доля генома в одном рекомбинантном
можно далее показать как:
куда,
размер вставки
размер генома
Таким образом, увеличение размера вставки (путем выбора вектора) позволит уменьшить количество клонов, необходимых для представления генома. Отношение размера вставки к размеру генома представляет собой долю соответствующего генома в одном клоне. Вот уравнение со всеми рассматриваемыми частями:
Пример выбора вектора
Вышеупомянутая формула может использоваться для определения уровня достоверности 99%, что все последовательности в геноме представлены с использованием вектора с размером вставки в двадцать тысяч пар оснований (например, фагового лямбда-вектора). Размер генома организма в этом примере составляет три миллиарда пар оснований.
клоны
Таким образом, требуется приблизительно 688 060 клонов, чтобы гарантировать 99% -ную вероятность того, что данная последовательность ДНК из этого генома с тремя миллиардами пар оснований будет присутствовать в библиотеке с использованием вектора с размером вставки в двадцать тысяч пар оснований.
Приложения
После создания библиотеки геном организма можно секвенировать, чтобы выяснить, как гены влияют на организм, или сравнить похожие организмы на уровне генома. Вышеупомянутые полногеномные ассоциативные исследования могут идентифицировать гены-кандидаты, проистекающие из многих функциональных признаков. Гены можно выделить с помощью геномных библиотек и использовать в линиях клеток человека или животных моделях для дальнейших исследований. Кроме того, создание клонов с высокой точностью воспроизведения с точным представлением генома и без проблем со стабильностью может также стать промежуточным звеном для секвенирования дробовика или исследования полных генов в функциональном анализе.
Иерархическая последовательность
Одним из основных видов использования геномных библиотек является иерархическое секвенирование с дробовиком , которое также называется секвенированием сверху вниз, на основе карты или клон за клоном. Эта стратегия была разработана в 1980-х годах для секвенирования целых геномов до того, как стали доступны высокопроизводительные методы секвенирования. Отдельные клоны из геномных библиотек можно разделить на более мелкие фрагменты, обычно от 500 до 1000 пар оснований, которые более удобны для секвенирования. После секвенирования клона из геномной библиотеки последовательность можно использовать для скрининга библиотеки на наличие других клонов, содержащих вставки, которые перекрываются с секвенированным клоном. Затем можно секвенировать любые новые перекрывающиеся клоны, образуя контиг . Этот метод, называемый ходьбой по хромосомам , можно использовать для секвенирования целых хромосом.
Полногеномное секвенирование - это еще один метод секвенирования генома, который не требует библиотеки векторов высокой емкости. Скорее, он использует компьютерные алгоритмы для сборки коротких считываний последовательностей, охватывающих весь геном. По этой причине геномные библиотеки часто используются в сочетании с полногеномным секвенированием. Карта высокого разрешения может быть создана путем секвенирования обоих концов вставок из нескольких клонов в геномной библиотеке. Эта карта предоставляет последовательности известных расстояний друг от друга, которые могут использоваться для помощи при сборке считываний последовательностей, полученных с помощью секвенирования дробовика. Последовательность генома человека, которая была объявлена завершенной в 2003 году, была собрана с использованием как библиотеки ВАС, так и секвенирования дробовика.
Полногеномные ассоциативные исследования
Полногеномные ассоциативные исследования - это общие приложения для поиска конкретных генных мишеней и полиморфизмов в пределах человеческой расы. Фактически, международный проект HapMap был создан благодаря партнерству ученых и агентств из нескольких стран для каталогизации и использования этих данных. Цель этого проекта - сравнить генетические последовательности разных людей, чтобы выяснить сходства и различия в хромосомных регионах. Ученые из всех участвующих стран каталогизируют эти атрибуты с данными о популяциях африканского, азиатского и европейского происхождения. Такие общегеномные оценки могут привести к дальнейшим диагностическим и лекарственным методам лечения, а также помочь будущим командам сосредоточиться на согласовании терапевтических методов с учетом генетических особенностей. Эти концепции уже используются в генной инженерии . Например, группа исследователей фактически сконструировала челночный вектор PAC, который создает библиотеку, представляющую двукратный охват генома человека. Это может послужить невероятным ресурсом для идентификации генов или наборов генов, вызывающих болезнь. Более того, эти исследования могут служить мощным способом изучения регуляции транскрипции, как это было замечено при изучении бакуловирусов. В целом, успехи в создании библиотеки геномов и секвенировании ДНК позволили эффективно обнаруживать различные молекулярные мишени. Усвоение этих свойств с помощью таких эффективных методов может ускорить использование новых кандидатов в лекарственные препараты.
использованная литература
дальнейшее чтение
Клуг, Каммингс, Спенсер, Палладино (2010). Основы генетики . Пирсон. С. 355–264. ISBN 978-0-321-61869-6.CS1 maint: несколько имен: список авторов ( ссылка )










![N = {\ frac {ln (1-0.99)} {ln [1 - {\ frac {2.0 \ times 10 ^ {4} basepairs} {3.0 \ times 10 ^ {9} basepairs}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/053b596ba7adfc402824b91ceae3dd24973b2fec)


