Аминирование Бухвальда – Хартвига - Buchwald–Hartwig amination
| Аминирование Бухвальда-Хартвига | |
|---|---|
| Названный в честь |
Стивен Л. Бухвальд Джон Ф. Хартвиг |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Бухвальд-Хартвиг-реакция |
| ID онтологии RSC | RXNO: 0000192 |
Аминирование Бухвальд-Хартвиг является химическая реакция используется в органической химии для синтеза углерод-азотных связей через палладий-катализируемых реакций сочетания аминов с арилгалогенидами . Хотя Pd-катализируемое связывание CN было зарегистрировано еще в 1983 году, следует упомянуть Стивена Л. Бухвальда и Джона Ф. Хартвига , чьи публикации между 1994 и концом 2000-х годов установили масштабы превращения. Синтетическая полезность реакции проистекает в первую очередь из недостатков типичных методов ( нуклеофильное замещение , восстановительное аминирование и т.д.) синтеза ароматических связей C – N, при этом большинство методов страдают от ограниченного объема субстрата и толерантности функциональной группы. Развитие реакции Бухвальда – Хартвига позволило легко синтезировать ариламины, заменив в некоторой степени более жесткие методы ( реакция Голдберга , нуклеофильное ароматическое замещение и т. Д.), При этом значительно расширив репертуар возможного образования связи C – N.
-
( Уравнение 1 )
В ходе его разработки было разработано несколько «поколений» каталитических систем, каждая из которых допускает больший диапазон с точки зрения партнеров для связывания и более мягких условий, позволяя связывать практически любой амин с широким спектром арильных партнеров для связывания. Из-за повсеместного распространения арил-CN-связей в фармацевтических препаратах и натуральных продуктах , реакция получила широкое применение в синтетической органической химии, с применением во многих общих синтезах и промышленном получении множества фармацевтических препаратов.
История
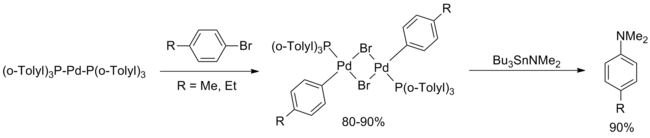
Первый пример палладиевого катализатора С-Н кросс-сочетания реакция была опубликована в 1983 году Migita и коллегами и описал реакцию между несколькими арилбромидов и N, N-диэтиламино-трибутил олова с использованием 1 моль% PdCl 2 [P (о- толил) 3 ] 2 . Хотя было испытано несколько арилбромидов, только электронно-нейтральные , стерически незагруженные подложки дали выход от хорошего до отличного.
-
( Уравнение 2 )
В 1984 году Дейл Л. Богер и Джеймс С. Панек сообщили о примере образования связи C – N с помощью Pd (0) в контексте своей работы по синтезу лавендамицина, в котором используется стехиометрический Pd (PPh 3 ) 4 . Попытки сделать реакцию каталитической не увенчались успехом.
-
( Уравнение 3 )
Эти отчеты практически не цитировались в течение десяти лет. В феврале 1994 года Хартвиг сообщил о систематическом исследовании соединений палладия, включенных в оригинальную статью Migita, сделав вывод, что активным катализатором является комплекс d 10 Pd [P (o-Tolyl) 3 ] 2 . Предложен каталитический цикл, включающий окислительное добавление арилбромида.
-
( Уравнение 4 )
В мае 1994 года Бухвальд опубликовал расширение статьи Migita, предлагающее два основных улучшения по сравнению с исходной статьей. Во-первых, переаминирование Bu 3 SnNEt 2 с последующей продувкой аргоном для удаления летучего диэтиламина позволило распространить методологию на множество вторичных аминов (как циклических, так и ациклических) и первичных анилинов . Во-вторых, выход аренов с высоким и низким содержанием электронов был улучшен за счет незначительных модификаций процедуры реакции (более высокая загрузка катализатора, более высокая температура, более длительное время реакции), хотя в эту публикацию не были включены орто- замещенные арильные группы.
-
( Уравнение 5 )
В 1995 году последовательные исследования в каждой лаборатории показали, что связывание можно проводить со свободными аминами в присутствии объемного основания ( NaOtBu в публикации Бухвальда, LiHMDS в публикации Хартвига), что позволяет проводить связывание без оловоорганического соединения. Хотя эти улучшенные условия протекали быстрее, объем субстрата был почти полностью ограничен вторичными аминами из-за конкурентного гидродегалогенирования бромаренов. (См. Механизм ниже)
-
( Уравнение 6 )
Эти результаты позволили создать так называемое «первое поколение» каталитических систем Бухвальда – Хартвига. В следующие годы были разработаны более сложные фосфиновые лиганды, которые позволили расширить спектр аминов и арильных групп. Арильные йодиды , хлориды и трифлаты в конечном счете стали пригодными субстратами, а реакции протекают с более слабыми были разработаны основы при комнатной температуре. Эти достижения подробно описаны в разделе « Объем » ниже, и расширение до более сложных систем остается активной областью исследований.
Механизм
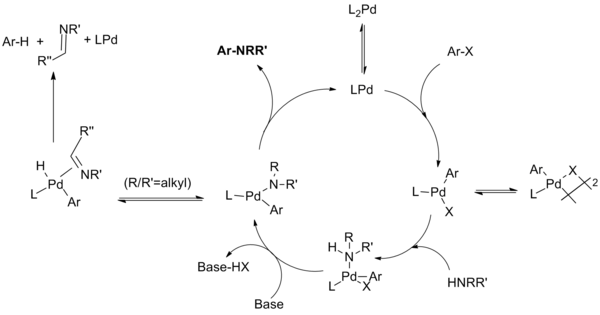
Механизм реакции для этой реакции было продемонстрировано , чтобы пройти через шаги аналогичных тем , которые известны катализируемой палладием реакции сочетания СС. Этапы включают окислительное добавление арилгалогенида к разновидностям Pd (0), добавление амина к окислительному аддитивному комплексу, депротонирование с последующим восстановительным отщеплением . Непродуктивная побочная реакция может конкурировать с восстановительным элиминированием , в котором амид подвергается элиминации беты гидрида с получением указанных в hydrodehalogenated арен и имин продукта.
На протяжении всей разработки реакции группа стремилась идентифицировать промежуточные продукты реакции посредством фундаментальных механистических исследований. Эти исследования выявили различные пути реакции в зависимости от того , используются ли в реакции монодентатные или хелатирующие фосфиновые лиганды, и был выявлен ряд нюансов влияния (особенно в отношении диалкилбиарилфосфиновых лигандов, разработанных Бухвальдом).
Каталитический цикл протекает следующим образом:
-
( Ур.7 )
Для систем с монодентатным лигандом, как полагают, частицы монофосфин-палладия (0) образуют частицы палладия (II), которые находятся в равновесии с димером μ-галогена. Стабильность этого димера снижается в порядке X = I> Br> Cl, и считается, что он ответственен за медленную реакцию арилиодидов с каталитической системой первого поколения. Лигирование амина с последующим депротонированием основанием дает амид палладия. (Было показано, что хелатирующие системы проходят эти две стадии в обратном порядке, при этом образование комплекса с основанием предшествует образованию амида.) Этот ключевой промежуточный продукт восстанавливается с образованием продукта и регенерации катализатора. Однако может происходить побочная реакция, при которой отщепление β-гидрида с последующим восстановительным отщеплением дает гидродегалогенированный арен и соответствующий имин. Не показаны дополнительные равновесия, в которых различные промежуточные соединения координируются с дополнительными фосфиновыми лигандами на различных стадиях каталитического цикла.
Для хелатирующих лигандов разновидности монофосфин-палладия не образуются; окислительное присоединение, образование амида и восстановительное отщепление происходят из комплексов L 2 Pd. Группа Хартвига обнаружила, что «восстановительное отщепление может происходить либо из четырехкоординатного бисфосфинового, либо из трехкоординированного амидокомплекса монофосфин арилпалладий. Удаление из трехкоординированных соединений происходит быстрее. Во-вторых, отщепление β-водорода происходит из трехкоординированного промежуточного соединения. Следовательно, отщепление β-водорода происходит медленно из комплексов арилпалладия, содержащих хелатирующие фосфины, в то время как восстановительное отщепление все еще может происходить из этих четырехкоординированных частиц ».
заявка
Из-за повсеместного распространения арил-CN-связей в фармацевтических препаратах и натуральных продуктах , реакция получила широкое применение в синтетической органической химии, с применением во многих общих синтезах и промышленном получении множества фармацевтических препаратов. Промышленное применение включает α-арилирование карбонильных соединений (таких как кетоны, сложные эфиры, амиды, альдегиды) и нитрилов.
Объем
Хотя объем аминирования Бухвальда-Хартвига был расширен за счет включения широкого спектра арильных и аминных партнеров связывания, условия, необходимые для любых конкретных реагентов, все еще в значительной степени зависят от субстрата. Были разработаны различные системы лигандов, каждая с различными возможностями и ограничениями, и выбор условий требует учета стерических и электронных свойств обоих партнеров. Ниже подробно описаны субстраты и условия для основных поколений лигандных систем. (Здесь не включены N-гетероциклические карбеновые лиганды и лиганды с широким углом прикуса, такие как Xantphos и Spanphos, которые также были значительно разработаны).
Каталитическая система первого поколения
Каталитическая система первого поколения (Pd [P (o-Tolyl) 3 ] 2 ) оказалась эффективной для сочетания как циклических, так и ациклических вторичных аминов, несущих как алкильную, так и арильную функциональную группу (но не диариламинов), с различными арилбромидами. . Как правило, эти условия не позволяли связывать первичные амины из-за конкурентного гидродегалогенирования арена.
Было обнаружено, что арилиодиды являются подходящими субстратами для внутримолекулярного варианта этой реакции и, что важно, могут быть связаны межмолекулярно, только если диоксан используется вместо толуола в качестве растворителя, хотя и с умеренными выходами.
Бидентатные фосфиновые лиганды
Разработка дифенилфосфинобинафтила (BINAP) и дифенилфосфиноферроцена (DPPF) в качестве лигандов для аминирования Бухвальда – Хартвига обеспечила первое надежное расширение первичных аминов и позволило эффективно сочетать арилиодиды и трифлаты. (Считается, что бидентатные лиганды предотвращают образование димера иодида палладия после окислительного добавления, ускоряя реакцию.) Эти лиганды обычно производят связанные продукты с более высокими скоростями и лучшими выходами, чем катализаторы первого поколения. Первоначальные сообщения об этих лигандах как катализаторах были несколько неожиданными, учитывая механистические доказательства монолигированных комплексов, служащих активными катализаторами в системе первого поколения. Фактически, первые примеры из обеих лабораторий были опубликованы в одном выпуске JACS .
-
( Уравнение 8 )
Комплексообразования этих лигандов , как полагают, устранение подавляют бета-гидридные путем предотвращения открытого сайта координации. Фактически, было обнаружено, что α-хиральные амины не рацемизируются при использовании хелатирующих лигандов, в отличие от каталитической системы первого поколения.
-
( Ур.9 )
Стерически затрудненные лиганды
Было показано, что объемные три- и диалкилфосфиновые лиганды являются чрезвычайно активными катализаторами, позволяющими сочетать широкий спектр аминов (первичных, вторичных, электроноакцепторных, гетероциклических и т. Д.) С арилхлоридами, бромидами, йодидами и трифлатами. . Кроме того, были разработаны реакции с использованием гидроксидных , карбонатных и фосфатных оснований вместо традиционных алкоксидных и силиламидных оснований. Группа Бухвальда разработала широкий спектр диалкилбиарилфосфиновых лигандов , в то время как группа Хартвига сосредоточилась на производных ферроцена и триалкилфосфиновых лигандах.
-
( Ур.10 )
Резкое увеличение активности, наблюдаемое с этими лигандами, объясняется их склонностью стерически отдавать предпочтение монолигированным частицам палладия на всех стадиях каталитического цикла, резко увеличивая скорость окислительного добавления, образования амида и восстановительного удаления. Некоторые из этих лигандов также, по-видимому, увеличивают скорость восстановительного элиминирования по сравнению с элиминированием β-гидрида через электронодонорное взаимодействие арен-палладий.
Даже электроноакцепторные амины и гетероциклические субстраты могут быть связаны в этих условиях, несмотря на их тенденцию дезактивировать палладиевый катализатор.
-
( Уравнение 11 )
Аммиачные эквиваленты
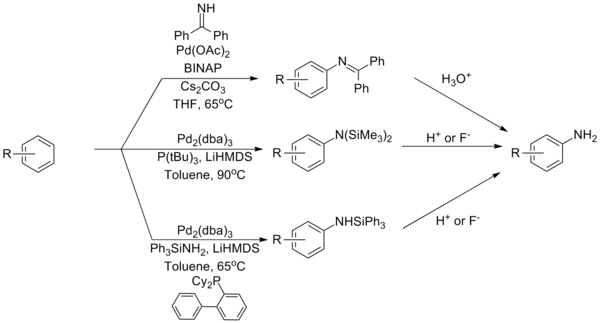
Аммиак остается одним из наиболее сложных партнеров для реакций аминирования Бухвальда – Хартвига, проблема связана с его прочным связыванием с комплексами палладия. Для решения этой проблемы было разработано несколько стратегий на основе реагентов, которые служат эквивалентами аммиака. Использование бензофенонимина или силиламида может преодолеть это ограничение с последующим гидролизом с получением первичного анилина .
-
( Уравнение 12 )
Каталитическая система, которая может напрямую связывать аммиак с использованием лиганда типа Josiphos.
Варианты муфт CN: муфты CO, CS и CC
В условиях, аналогичных тем, которые используются для аминирования, спирты и могут быть связаны с арилгалогенидами с образованием соответствующих ариловых эфиров . Это служит удобной заменой более жестких аналогов этого процесса, таких как конденсация Ульмана .
-
( Уравнение 13 )
Тиолы и тиофенолы могут быть связаны с арилгалогенидами в условиях типа Бухвальда-Хартвига с получением соответствующих арилтиоэфиров. Кроме того, меркаптоэфиры использовались в качестве H 2 S-эквивалентов для получения тиофенола из соответствующего арилгалогенида.
Енолаты и другие подобные углеродные нуклеофилы также могут быть связаны с образованием α-арилкетонов, малонатов, нитрилов и т. Д. Масштабы этой трансформации также зависят от лиганда, и был разработан ряд систем. Для этого процесса было разработано несколько энантиоселективных методов.
-
( Уравнение 14 )
Также было разработано несколько вариантов реакции с использованием комплексов меди и никеля, а не палладия.
Рекомендации
внешние ссылки
- Связка Бухвальда – Хартвига - Недавняя литература
- Аминирование Бухвальда – Хартвига - Синтетические протоколы от organic-reaction.com
- Buchwald – Hartwig Chemistry Ian Mangion Заседание группы MacMillan 30 июля 2002 г. Ссылка
- Реакция Бухвальда – Хартвига Катализаторы на основе драгоценных металлов от Acros Organics для реакций сочетания в органическом синтезе Link