Биоортогональная химия -Bioorthogonal chemistry
Термин « биоортогональная химия» относится к любой химической реакции , которая может происходить внутри живых систем, не мешая естественным биохимическим процессам. Этот термин был придуман Кэролин Р. Бертоцци в 2003 году. С момента своего появления концепция биоортогональной реакции позволила изучать биомолекулы, такие как гликаны , белки и липиды , в реальном времени в живых системах без клеточной токсичности. Был разработан ряд стратегий химического лигирования, отвечающих требованиям биоортогональности, включая 1,3-диполярное циклоприсоединение между азидами и циклооктинами.(также называемая клик-химией без меди ), между нитронами и циклооктинами, образованием оксима / гидразона из альдегидов и кетонов , лигированием тетразина , клик-реакцией на основе изоцианида и, совсем недавно, лигированием квадрициклана.
Использование биоортогональной химии обычно происходит в два этапа. Во-первых, клеточный субстрат модифицируют биоортогональной функциональной группой (химическим репортером) и вводят в клетку; субстраты включают метаболиты, ингибиторы ферментов и т. д. Химический репортер не должен резко изменять структуру субстрата, чтобы не повлиять на его биологическую активность. Во-вторых, зонд, содержащий комплементарную функциональную группу, вводится для реакции и мечения субстрата.
Хотя были разработаны эффективные биоортогональные реакции, такие как химия щелчков без меди, разработка новых реакций продолжает создавать ортогональные методы мечения, позволяющие использовать несколько методов мечения в одних и тех же биосистемах. Бертоцци была удостоена Нобелевской премии по химии в 2022 году за разработку клик-химии и биоортогональной химии.
Этимология
Слово «биоортогональный» происходит от греческого слова « био » — «живой» и « ортогониос » — «прямоугольный». Таким образом, буквально реакция идет перпендикулярно живой системе, не нарушая ее.
Требования к биоортогональности
Чтобы считаться биоортогональной, реакция должна соответствовать ряду требований:
- Селективность: реакция должна быть селективной в отношении эндогенных функциональных групп, чтобы избежать побочных реакций с биологическими соединениями.
- Биологическая инертность: Реактивные партнеры и возникающая в результате связь не должны обладать каким-либо видом реактивности, способным нарушить нативную химическую функциональность изучаемого организма.
- Химическая инертность: ковалентная связь должна быть прочной и инертной к биологическим реакциям.
- Кинетика: реакция должна быть быстрой, чтобы ковалентное лигирование произошло до метаболизма и клиренса зонда. Реакция должна быть быстрой, в масштабе времени клеточных процессов (минуты), чтобы предотвратить конкуренцию в реакциях, которые могут ослабить слабые сигналы менее распространенных видов. Быстрые реакции также обеспечивают быструю реакцию, необходимую для точного отслеживания динамических процессов.
- Биосовместимость реакции: реакции должны быть нетоксичными и должны протекать в биологических условиях с учетом рН, водной среды и температуры. Фармакокинетика вызывает все большую озабоченность по мере того, как биоортогональная химия расширяется до моделей живых животных.
- Доступная инженерия: химический репортер должен быть способен встраиваться в биомолекулы с помощью какой-либо формы метаболической или белковой инженерии. Оптимально, чтобы одна из функциональных групп была очень маленькой, чтобы не мешать нативному поведению.
перевязка Штаудингера
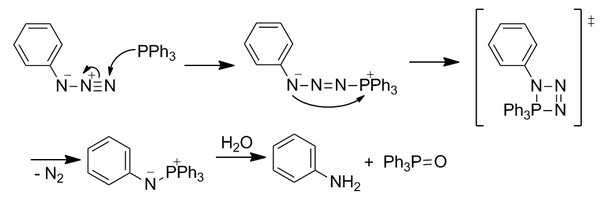
Лигирование Штаудингера — это реакция, разработанная группой Бертоцци в 2000 году и основанная на классической реакции Штаудингера азидов с триарилфосфинами. Он открыл область биоортогональной химии как первую реакцию с полностью абиотическими функциональными группами, хотя она уже не так широко используется. Лигирование Штаудингера использовалось как для живых клеток, так и для живых мышей.
Биоортогональность
Азид может действовать как мягкий электрофил , предпочитающий мягкие нуклеофилы, такие как фосфины . Это отличается от большинства биологических нуклеофилов, которые обычно являются жесткими нуклеофилами. Реакция протекает селективно в устойчивых к воде условиях с образованием стабильного продукта.
Фосфины полностью отсутствуют в живых системах и не восстанавливают дисульфидные связи, несмотря на умеренный восстановительный потенциал. Было показано, что азиды биосовместимы с одобренными FDA лекарствами, такими как азидотимидин, и при других применениях в качестве сшивающих агентов. Кроме того, их небольшой размер позволяет им легко включаться в биомолекулы посредством клеточных метаболических путей.
Механизм
Классическая реакция Штаудингера
Нуклеофильный фосфин атакует азид по электрофильному концевому азоту. Через четырехчленное переходное состояние N 2 теряется с образованием азаилида. Нестабильный илид гидролизуется с образованием оксида фосфина и первичного амина. Однако эта реакция не является сразу биоортогональной, поскольку гидролиз разрывает ковалентную связь в азаилиде.
перевязка Штаудингера
Реакцию модифицировали, чтобы включить сложноэфирную группу в орто-положении к атому фосфора на одном из арильных колец, чтобы направить азаилид по новому пути реакционной способности, чтобы превзойти немедленный гидролиз путем размещения сложного эфира для увеличения локальной концентрации. Начальная нуклеофильная атака азида является лимитирующей стадией. Илид реагирует с ловушкой электрофильного сложного эфира посредством внутримолекулярной циклизации с образованием пятичленного кольца. Это кольцо подвергается гидролизу с образованием стабильной амидной связи.
Ограничения
Фосфиновые реагенты медленно окисляются воздухом в живых системах. Кроме того, вполне вероятно, что они метаболизируются in vitro ферментами цитохрома Р450 .
Кинетика реакций медленная с константами скорости второго порядка около 0,0020 М -1 • с -1 . Попытки увеличить скорость нуклеофильной атаки путем добавления электронодонорных групп к фосфинам улучшили кинетику, но также увеличили скорость окисления воздухом.
Плохая кинетика требует использования высоких концентраций фосфина, что приводит к проблемам с высоким фоновым сигналом в приложениях для визуализации. Были предприняты попытки решить проблему высокого фона путем разработки флуорогенных фосфиновых реагентов на основе флуоресцеина и люциферина , но внутренняя кинетика остается ограничением.
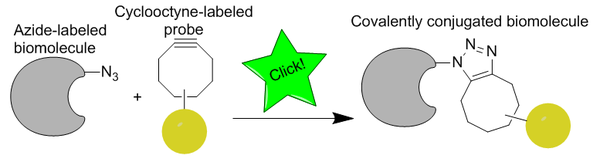
Щелчковая химия без меди
Щелчковая химия без меди - это биоортогональная реакция, впервые разработанная Кэролин Бертоцци как активированный вариант азид-алкинового циклоприсоединения Хьюсгена на основе работы Карла Барри Шарплесса и соавт. В отличие от CuAAC, химия щелчков без меди была изменена, чтобы стать биоортогональной за счет исключения цитотоксического медного катализатора, что позволяет реакции протекать быстро и без токсичности живых клеток. Вместо меди реакция представляет собой промотируемое напряжением алкин-азидное циклоприсоединение ( SPAAC ). Он был разработан как более быстрая альтернатива лигированию Штаудингера, при этом первые поколения реагировали более чем в шестьдесят раз быстрее. Биоортогональность реакции позволила применить щелчковую реакцию без меди в культивируемых клетках, живых рыбках данио и мышах.
Токсичность меди
Классическое азид-алкиновое циклоприсоединение, катализируемое медью, является чрезвычайно быстрой и эффективной клик-реакцией для биоконъюгации, но оно не подходит для использования в живых клетках из-за токсичности ионов Cu(I). Токсичность обусловлена окислительным повреждением активных форм кислорода, образованных медными катализаторами. Также было обнаружено, что комплексы меди вызывают изменения в клеточном метаболизме и поглощаются клетками.
Были разработаны лиганды для предотвращения повреждения биомолекул и облегчения их удаления в применениях in vitro . Однако было обнаружено, что различные лигандные окружения комплексов все еще могут влиять на метаболизм и поглощение, вызывая нежелательные нарушения клеточной функции.
Биоортогональность
Азидная группа особенно биоортогональна, потому что она чрезвычайно мала (благоприятна для проницаемости клеток и позволяет избежать возмущений), метаболически стабильна и не существует в природе в клетках и, следовательно, не имеет конкурирующих биологических побочных реакций. Хотя азиды не являются наиболее реакционноспособными 1,3-диполями, доступными для реакции, они предпочтительнее из-за их относительного отсутствия побочных реакций и стабильности в типичных условиях синтеза. Алкин не такой маленький, но все же обладает стабильностью и ортогональностью, необходимыми для мечения in vivo . Циклооктины традиционно являются наиболее распространенными циклоалкинами для исследований по маркировке, поскольку они представляют собой наименьшее стабильное алкиновое кольцо.
Механизм
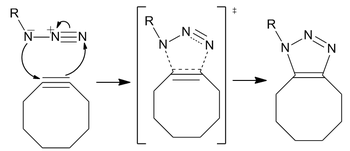
Реакция протекает как стандартное 1,3-диполярное циклоприсоединение, тип асинхронного согласованного перициклического сдвига. Амбивалентная природа 1,3 - диполя должна сделать невозможной идентификацию электрофильного или нуклеофильного центра на азиде, так что направление циклического потока электронов не имеет смысла. [p] Однако расчеты показали, что распределение электронов среди атомов азота приводит к тому, что самый внутренний атом азота несет наибольший отрицательный заряд.
региоселективность
Хотя в результате реакции образуется региоизомерная смесь триазолов, отсутствие региоселективности в реакции не является серьезной проблемой для большинства современных применений. Более региоспецифическим и менее биоортогональным требованиям лучше всего удовлетворяет катализируемое медью циклоприсоединение Хьюсгена, особенно с учетом синтетической сложности (по сравнению с добавлением терминального алкина) синтеза деформированного циклооктина.
Разработка циклооктинов
| Циклооктин | Константа скорости второго порядка (М -1 с -1 ) |
|---|---|
| ОКТ | 0,0024 |
| АЛО | 0,0013 |
| МОФО | 0,0043 |
| ДИФО | 0,076 |
| ДИБО | 0,057 |
| БАРАК | 0,96 |
| ДИБАК (АДИБО) | 0,31 |
| ДИМАК | 0,0030 |
OCT был первым циклооктином, разработанным для клик-химии, не содержащей меди. В то время как линейные алкины не вступают в реакцию при физиологических температурах, ОСТ способен легко реагировать с азидами в биологических условиях, не проявляя при этом токсичности. Однако он был плохо растворим в воде, и его кинетика была едва лучше, чем при лигировании Штаудингера. ALO (безариловый октин) был разработан для улучшения растворимости в воде, но он по-прежнему имел плохую кинетику.
Монофторированные ( MOFO ) и дифторированные ( DIFO ) циклооктины были созданы для увеличения скорости за счет добавления электроноакцепторных фтористых заместителей в пропаргильном положении. Фтор является хорошей электроноакцепторной группой с точки зрения синтетической доступности и биологической инертности. В частности, он не может образовывать электрофильный акцептор Михаэля , который может вступать в побочную реакцию с биологическими нуклеофилами. DIBO (дибензоциклооктин) был разработан как сплав двух арильных колец, что привело к очень высокой деформации и снижению энергии искажения. Было высказано предположение, что замена биарилом увеличивает напряжение кольца и обеспечивает конъюгацию с алкином для улучшения реакционной способности. Хотя расчеты предсказывают, что моноарилзамещение обеспечит оптимальный баланс между стерическим столкновением (с молекулой азида) и напряжением, было показано, что моноарилированные продукты нестабильны.
BARAC (биарилазациклооктинон) с последующим добавлением амидной связи, которая добавляет sp 2 -подобный центр для увеличения скорости за счет искажения. Амидный резонанс вносит дополнительную деформацию, не создавая дополнительной ненасыщенности, которая привела бы к нестабильности молекулы. Кроме того, добавление гетероатома в кольцо циклооктина улучшает как растворимость, так и фармакокинетику молекулы. BARAC имеет достаточную скорость (и чувствительность) до такой степени, что смывание избыточного зонда не требуется для уменьшения фона. Это делает его чрезвычайно полезным в ситуациях, когда мытье невозможно, например, при визуализации в реальном времени или при визуализации всего животного. Хотя BARAC чрезвычайно полезен, его низкая стабильность требует, чтобы он хранился при температуре 0 °C в защищенном от света и кислорода месте.
Были выполнены дальнейшие корректировки вариантов BARAC для получения DIBAC/ADIBO , чтобы добавить напряжение дистального кольца и уменьшить стерические характеристики вокруг алкина для дальнейшего повышения реакционной способности. Кето-ДИБО, в котором гидроксильная группа была преобразована в кетон, имеет трехкратное увеличение скорости из-за изменения конформации кольца. Попытки получить дифторбензоциклооктин ( ДИФБО ) не увенчались успехом из-за нестабильности.
Проблемы с DIFO в исследованиях на мышах in vivo иллюстрируют сложность получения биоортогональных реакций. Хотя DIFO был чрезвычайно активен при мечении клеток, он плохо работал в исследованиях на мышах из-за связывания с сывороточным альбумином . Гидрофобность циклооктина способствует секвестрации мембранами и белками сыворотки, снижая биодоступные концентрации. В ответ на это был разработан DIMAC (диметоксиазациклооктин) для повышения растворимости в воде, полярности и фармакокинетики, хотя усилия по биоортогональному мечению мышиных моделей все еще находятся в разработке.
Реактивность
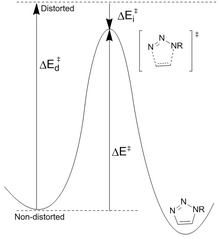
Вычислительные усилия были жизненно важны для объяснения термодинамики и кинетики этих реакций циклоприсоединения, которые сыграли жизненно важную роль в дальнейшем улучшении реакции. Существует два метода активации алкинов без ущерба для стабильности: уменьшение энергии переходного состояния или снижение стабильности реагентов.

Снижение стабильности реагентов: Хоук предположил, что различия в энергии (E d ‡ ), необходимой для преобразования азида и алкина в геометрию переходного состояния, контролируют высоту барьера для реакции. Энергия активации (E ‡ ) представляет собой сумму дестабилизирующих искажений и стабилизирующих взаимодействий (E i ‡ ). Наиболее значительное искажение наблюдается в азидной функциональной группе с меньшим вкладом алкинового искажения. Однако только циклооктин можно легко модифицировать для повышения реакционной способности. Рассчитанные барьеры реакции для фенилазида и ацетилена (16,2 ккал/моль) по сравнению с циклооктином (8,0 ккал/моль) приводят к прогнозируемому увеличению скорости на 10 6 . Циклооктин требует меньше энергии искажения (1,4 ккал/моль против 4,6 ккал/моль), что приводит к более низкой энергии активации, несмотря на меньшую энергию взаимодействия.
Уменьшение энергии переходного состояния: электроноакцепторные группы, такие как фтор, увеличивают скорость за счет уменьшения энергии НСМО и промежутка ВЗМО-НСМО. Это приводит к большему переносу заряда от азида к фторированному циклооктину в переходном состоянии, увеличению энергии взаимодействия (меньшее отрицательное значение) и общей энергии активации. Понижение НСМО является результатом гиперконъюгации между алкиновыми π-донорными орбиталями и CF σ*-акцепторами. Эти взаимодействия обеспечивают стабилизацию прежде всего в переходном состоянии за счет повышения донорно-акцепторной способности связей по мере их искажения. Расчеты NBO показали, что искажение переходного состояния увеличивает энергию взаимодействия на 2,8 ккал/моль.
Гиперсопряжение между π-связями вне плоскости больше, потому что π-связи в плоскости плохо выровнены. Однако изгиб переходного состояния позволяет π-связям в плоскости иметь более антиперипланарное расположение, что облегчает взаимодействие. Дополнительная стабилизация энергии гиперсопряженного взаимодействия достигается за счет увеличения электронной заселенности σ* за счет образующейся связи CN. Отрицательная гиперконъюгация со связями σ* CF усиливает это стабилизирующее взаимодействие.
региоселективность
Хотя региоселективность не является большой проблемой в текущих приложениях для визуализации безмедной химии щелчков, это проблема, которая препятствует будущим применениям в таких областях, как дизайн лекарств или пептидомиметики.
В настоящее время большинство циклооктинов реагируют с образованием региоизомерных смесей. [m] Вычислительный анализ показал, что, хотя региоселективность газовой фазы рассчитана в пользу добавления 1,5 по сравнению с добавлением 1,4 с энергией активации до 2,9 ккал / моль, поправки на сольватацию приводят к одинаковым энергетическим барьерам для обоих региоизомеров. В то время как изомер 1,4 в циклоприсоединении DIFO неблагоприятен из-за его большего дипольного момента, сольватация стабилизирует его сильнее, чем изомер 1,5, разрушая региоселективность.
Симметричные циклооктины, такие как BCN (бицикло[6.1.0]нонин), образуют единый региоизомер при циклоприсоединении и могут служить для решения этой проблемы в будущем.
Приложения
Наиболее широкое применение клик-химии без меди - это биовизуализация живых клеток или животных с использованием биомолекулы с азидной меткой и циклооктина, несущего визуализирующий агент.
Флуоресцентные кето- и оксимные варианты DIBO используются в реакциях щелчка переключателя фтора, в которых флуоресценция циклооктина гасится триазолом, образующимся в реакции. С другой стороны, циклооктины, конъюгированные с кумарином, такие как coumBARAC , были разработаны таким образом, что алкин подавляет флуоресценцию, в то время как образование триазола увеличивает квантовый выход флуоресценции в десять раз.
Пространственный и временной контроль мечения субстрата был исследован с использованием фотоактивируемых циклооктинов. Это позволяет уравновесить алкин перед реакцией, чтобы уменьшить артефакты в результате градиентов концентрации. Замаскированные циклооктины не способны реагировать с азидами в темноте, но становятся реакционноспособными алкинами при облучении светом.
Химия щелчков без меди изучается для использования в синтезе агентов для визуализации ПЭТ , которые должны быть получены быстро с высокой чистотой и выходом, чтобы свести к минимуму изотопный распад до того, как соединения можно будет вводить. И высокие константы скорости, и биоортогональность SPAAC поддаются химии ПЭТ.
Другие биоортогональные реакции
Нитрондипольное циклоприсоединение
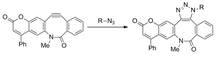
Химия щелчков без меди была адаптирована для использования нитронов в качестве 1,3-диполя, а не азидов, и использовалась для модификации пептидов.
Это циклоприсоединение между нитроном и циклооктином образует N-алкилированные изоксазолины. Скорость реакции увеличивается с помощью воды и является чрезвычайно высокой с константами скорости второго порядка в диапазоне от 12 до 32 М -1 • с -1 , в зависимости от замещения нитрона. Хотя реакция протекает очень быстро, она сталкивается с проблемами включения нитрона в биомолекулы посредством метаболической маркировки. Мечение было достигнуто только за счет посттрансляционной модификации пептида.
Норборнен циклоприсоединение
1,3-диполярные циклоприсоединения были разработаны как биоортогональная реакция с использованием оксида нитрила в качестве 1,3-диполя и норборнена в качестве диполярофила. Его основное применение заключалось в мечении ДНК и РНК в автоматических синтезаторах олигонуклеотидов и сшивании полимеров в присутствии живых клеток.
Норборнены были выбраны в качестве диполярофилов из-за их баланса между стимулируемой штаммом реактивностью и стабильностью. Недостатки этой реакции включают перекрестную реакционную способность оксида нитрила из-за сильной электрофильности и медленной кинетики реакции.
Оксанорборнадиеновое циклоприсоединение
Циклоприсоединение оксанорборнадиена представляет собой 1,3-диполярное циклоприсоединение, за которым следует ретро- реакция Дильса-Альдера с образованием триазол-связанного конъюгата с отщеплением молекулы фурана . Предварительная работа установила его полезность в экспериментах по мечению пептидов, а также его использовали для создания соединений для визуализации ОФЭКТ . Совсем недавно использование оксанорборнадиена было описано в реакции «iClick» при комнатной температуре без катализатора, в которой модельная аминокислота связана с фрагментом металла, в новом подходе к биоортогональным реакциям.
Деформация кольца и дефицит электронов в оксанорборнадиене увеличивают реакционную способность по отношению к стадии, ограничивающей скорость циклоприсоединения. После этого быстро происходит ретро-реакция Дильса-Альдера с образованием стабильного 1,2,3-триазола. Проблемы включают плохую переносимость заместителей, которые могут изменить электронику оксанорборнадиена, и низкие скорости (константы скорости второго порядка порядка 10 -4 ).
лигирование тетразином
Лигирование тетразина представляет собой реакцию транс-циклооктена и s- тетразина в обратной реакции Дильса-Альдера с последующей реакцией ретро-Дильса-Альдера для удаления газообразного азота. Реакция протекает чрезвычайно быстро с константой скорости второго порядка 2000 М- 1 -с- 1 (в метаноле /воде 9:1), что позволяет модифицировать биомолекулы при чрезвычайно низких концентрациях.
Основываясь на расчетной работе Баха, энергия деформации для Z-циклооктенов составляет 7,0 ккал/моль по сравнению с 12,4 ккал/моль для циклооктана из-за потери двух трансаннулярных взаимодействий. E-циклооктен имеет сильно закрученную двойную связь, что дает энергию деформации 17,9 ккал/моль. Таким образом, высоконапряженный транс-циклооктен используется в качестве реактивного диенофила . Диен представляет собой 3,6- диарил -s-тетразин, который был заменен, чтобы противостоять немедленной реакции с водой. Реакция протекает через начальное циклоприсоединение, за которым следует обратная реакция Дильса-Альдера для удаления N 2 и предотвращения обратимости реакции.
Мало того, что реакция устойчива к воде, но было обнаружено, что скорость увеличивается в водной среде. Реакции также проводились с использованием норборненов в качестве диенофилов при скоростях второго порядка порядка 1 М -1 • с -1 в водной среде. Реакция применялась для мечения живых клеток и связывания полимеров.
[4+1] Циклоприсоединение
Эта изоцианидная клик-реакция представляет собой циклоприсоединение [4+1], за которым следует ретро-отщепление Дильса-Альдера N 2 .
Реакция протекает с начальным циклоприсоединением [4+1], за которым следует реверсия для устранения термодинамического поглотителя и предотвращения обратимости. Этот продукт стабилен, если используется третичный амин или изоцианопропаноат. Если используется вторичный или первичный изоцианид, продукт образует имин , который быстро гидролизуется.
Изоцианид является предпочтительным химическим репортером из-за его небольшого размера, стабильности, нетоксичности и отсутствия в системах млекопитающих. Однако реакция протекает медленно, с константами скорости второго порядка порядка 10 -2 М -1 • с -1 .
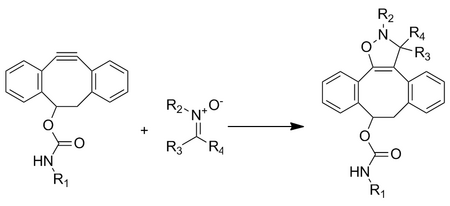
Тетразол фотоклик химия
Химия Photoclick использует фотоиндуцированное циклоэлиминирование для высвобождения N 2 . Это приводит к образованию короткоживущего промежуточного соединения 1,3-нитрил-имина за счет потери газообразного азота, которое подвергается 1,3-диполярному циклоприсоединению с алкеном с образованием пиразолиновых циклоаддуктов.
Фотоиндукция происходит при кратковременном воздействии света (длина волны зависит от тетразола), чтобы свести к минимуму фотоповреждение клеток. Реакция усиливается в водных условиях и приводит к образованию одного региоизомера.
Переходный нитрил-имин обладает высокой реакционной способностью в отношении 1,3-диполярного циклоприсоединения из-за изогнутой структуры, которая снижает энергию искажения. Замещение электронодонорными группами на фенильных кольцах увеличивает энергию ВЗМО при размещении на 1,3-нитрилимине и увеличивает скорость реакции.
Преимущества этого подхода включают возможность пространственного или временного контроля реакции и возможность включения как алкенов, так и тетразолов в биомолекулы с использованием простых биологических методов, таких как генетическое кодирование. Кроме того, тетразол можно сконструировать так, чтобы он был флуорогенным, чтобы отслеживать ход реакции.
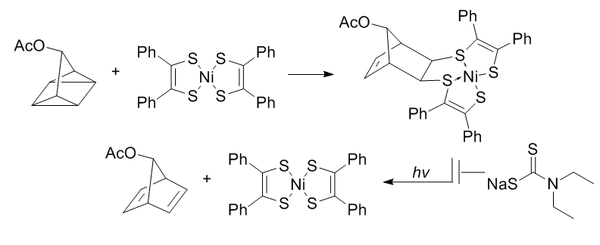
Лигирование квадрициклана
В лигировании квадрициклана используется сильно напряженный квадрициклан для прохождения [2 + 2 + 2] циклоприсоединения с π-системами.
Квадрициклан абиотичен, не реагирует с биомолекулами (из-за полного насыщения), относительно мал и сильно напряжен (~80 ккал/моль). Однако он очень стабилен при комнатной температуре и в водных условиях при физиологическом рН. Он способен избирательно реагировать с бедными электронами π-системами, но не с простыми алкенами, алкинами или циклооктинами.
Бис(дитиобензил)никель(II) был выбран в качестве партнера по реакции из списка кандидатов на основе реакционной способности. Чтобы предотвратить индуцированное светом превращение в норборнадиен, добавляют диэтилдитиокарбамат для хелатирования никеля в продукте.
Эти реакции усиливаются водными условиями с константой скорости второго порядка 0,25 М -1 • с -1 . Особый интерес представляет то, что было доказано, что он является биоортогональным как для образования оксима, так и для клик-химии, не содержащей меди.
Использование
Биоортогональная химия является привлекательным инструментом для предварительного планирования экспериментов в области ядерной визуализации и лучевой терапии .