Штамм (химия) - Strain (chemistry)
В химии , а молекула испытывает штамм , когда его химическая структура испытывает некоторое напряжение , которое повышает свою внутреннюю энергию в сравнении с недеформированным эталонным соединением . Внутренняя энергия молекулы состоит из всех энергии , хранящейся в нем. Напряженная молекула обладает дополнительной внутренней энергией, которой нет у ненастроенной молекулы. Эту дополнительную внутреннюю энергию или энергию деформации можно сравнить со сжатой пружиной . Подобно сжатой пружине, которую необходимо удерживать на месте, чтобы предотвратить высвобождение ее потенциальной энергии , молекула может удерживаться в энергетически неблагоприятной конформации за счет связей внутри этой молекулы. Без связей, удерживающих конформацию на месте, энергия деформации высвободилась бы.
Резюме
Термодинамика
Равновесия двух конформаций молекул определяются разницей в свободной энергии Гиббса двух конформаций. По этой разнице энергий можно определить константу равновесия для двух конформаций.
Если происходит уменьшение свободной энергии Гиббса от одного состояния к другому, это преобразование является спонтанным, и состояние с более низкой энергией является более стабильным . Сильно напряженная молекулярная конформация с более высокой энергией спонтанно преобразуется в молекулярную конформацию с более низкой энергией.
Энтальпия и энтропия связаны со свободной энергией Гиббса уравнением (при постоянной температуре ):
Энтальпия обычно является более важной термодинамической функцией для определения более стабильной молекулярной конформации. Хотя существуют разные типы деформации, энергия деформации, связанная со всеми ними, возникает из-за ослабления связей внутри молекулы. Поскольку энтальпия обычно более важна, энтропию часто можно игнорировать. Это не всегда так; если разница в энтальпии мала, энтропия может иметь большее влияние на равновесие. Например, н-бутан имеет две возможные конформации: анти и гош . Антиконформация более устойчива на 0,9 ккал моль -1 . Мы ожидаем, что бутан примерно на 82% антистатичен и на 18% гош при комнатной температуре. Однако возможны две гош-конформации и только одна анти-конформация. Следовательно, вклад энтропии в пользу гош-конформации составляет 0,4 ккал. Мы обнаружили, что фактическое конформационное распределение бутана составляет 70% анти и 30% гош при комнатной температуре.
Определение молекулярной деформации
Стандарт теплота образования (Δ F Н °) соединения описывается как изменение энтальпии , когда соединение образуется из его разделенных элементов. Когда теплота образования соединения отличается либо от прогнозируемого, либо от эталонного соединения, это различие часто можно отнести к деформации. Например, Δ f H ° для циклогексана составляет -29,9 ккал моль -1, а Δ f H ° для метилциклопентана составляет -25,5 ккал моль -1 . Несмотря на то, что у метилциклопентана такие же атомы и количество связей, он имеет более высокую энергию, чем циклогексан. Эта разница в энергии может быть объяснена деформацией пятичленного кольца, которое отсутствует в циклогексане. Экспериментально энергия деформации часто определяется с использованием теплоты сгорания, что обычно является простым экспериментом.
Определение энергии деформации внутри молекулы требует знания ожидаемой внутренней энергии без деформации. Это можно сделать двумя способами. Во-первых, его можно сравнить с аналогичным соединением, в котором отсутствует штамм, таким как в предыдущем примере с метилциклогексаном . К сожалению, часто бывает трудно получить подходящее соединение. Альтернативой является использование теории приращения группы Бенсона . Пока для атомов в соединении доступны подходящие групповые приращения, можно сделать прогноз Δ f H °. Если экспериментальная Δ f H ° отличается от прогнозируемой Δ f H °, эту разницу в энергии можно отнести к энергии деформации.
Виды штаммов
Штамм Ван-дер-Ваальса
Деформация Ван-дер-Ваальса , или стерическая деформация, возникает, когда атомы вынуждены приближаться ближе, чем позволяют их ван-дер-ваальсовые радиусы . В частности, деформация Ван-дер-Ваальса считается формой деформации, при которой взаимодействующие атомы находятся на расстоянии не менее четырех связей друг от друга. Количество стерического штамма в подобных молекулах зависит от размера взаимодействующих групп; объемные трет-бутильные группы занимают гораздо больше места, чем метильные группы, и часто испытывают большие стерические взаимодействия.
Эффекты стерического штамма в реакции триалкиламинов с триметилбором были изучены лауреатом Нобелевской премии Гербертом С. Брауном и соавт. Они обнаружили, что по мере увеличения размера алкильных групп амина константа равновесия также уменьшалась. Сдвиг равновесия приписывают стерическому напряжению между алкильными группами амина и метильными группами бора.
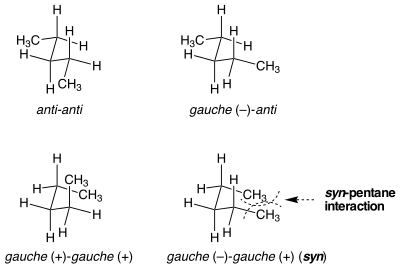
Синпентановый штамм
Бывают ситуации, когда кажущиеся идентичными конформации не равны по энергии деформации. Синпентановый штамм является примером такой ситуации. Есть два разных способа перевести обе связи, центральные в н- пентане, в гош-конформацию, одна из которых на 3 ккал моль -1 выше по энергии, чем другая. Когда две метилзамещенные связи поворачиваются от анти к гош в противоположных направлениях, молекула принимает конформацию, подобную циклопентану, где две концевые метильные группы сближаются. Если связки повернуты в одном направлении, этого не произойдет. Стерическое напряжение между двумя концевыми метильными группами объясняет разницу в энергии между двумя похожими, но очень разными конформациями.
Аллиловый штамм
Аллильный штамм или штамм A 1,3 тесно связан со штаммом синпентана. Пример аллильного штамма можно увидеть в соединении 2-пентен . Это возможно за этиловым заместитель олефина для вращения таким образом, что терминал метильной группы приближена к вицинальной метильной группе олефина. Эти типы соединений обычно принимают более линейную конформацию, чтобы избежать стерического напряжения между заместителями.
1,3-диаксиальная деформация
1,3-диаксиальный штамм - еще одна форма штамма, похожая на син-пентан. В этом случае деформация возникает из-за стерических взаимодействий между заместителем циклогексанового кольца ('α') и гош-взаимодействий между альфа-заместителем и обоими метиленовыми атомами углерода на расстоянии двух связей от рассматриваемого заместителя (следовательно, 1,3-диаксиальная взаимодействия). Когда заместитель является аксиальным , он приближается к аксиальному гамма-водороду. Степень деформации в значительной степени зависит от размера заместителя и может быть уменьшена путем формирования конформации основного кресла, помещая заместитель в экваториальное положение. Разница в энергии между конформациями называется величиной A и хорошо известна для многих различных заместителей. Значение A является термодинамическим параметром и первоначально измерялось вместе с другими методами с использованием уравнения свободной энергии Гиббса и, например, равновесия восстановления Меервейна – Понндорфа – Верлея / окисления Оппенауэра для измерения осевых и экваториальных значений циклогексанона / циклогексанола ( 0,7 ккал моль -1 ).
Деформация кручения
Деформация кручения - это сопротивление скручиванию. В циклических молекулах его еще называют штаммом Питцера .
Деформация кручения возникает, когда атомы, разделенные тремя связями, помещаются в затменную конформацию вместо более стабильной ступенчатой конформации. Барьер вращения между ступенчатыми конформациями этана составляет приблизительно 2,9 ккал моль -1 . Первоначально считалось, что барьер для вращения возникает из-за стерических взаимодействий между вицинальными атомами водорода, но ван-дер-ваальсовский радиус водорода слишком мал для этого. Недавние исследования показали, что ступенчатая форма тела может быть более стабильной из-за гиперконъюгативного эффекта . Вращение от шахматной формы прерывает эту стабилизирующую силу.
Более сложные молекулы, такие как бутан, имеют более одной возможной ступенчатой конформации. Антиконформация бутана примерно на 0,9 ккал моль -1 (3,8 кДж моль -1 ) более стабильна, чем конформация гош. Обе эти ступенчатые конформации намного более стабильны, чем затмеваемые конформации. Вместо гиперконъюгативного эффекта, такого как в этане , энергия деформации в бутане обусловлена как стерическими взаимодействиями между метильными группами, так и угловой деформацией, вызванной этими взаимодействиями.
Кольцевая деформация
Согласно теории молекулярных связей VSEPR , предпочтительной геометрией молекулы является та, в которой как связывающие, так и несвязывающие электроны находятся как можно дальше друг от друга. В молекулах эти углы довольно часто несколько сжимаются или расширяются по сравнению с их оптимальным значением. Эта деформация называется угловой деформацией или деформацией Байера. Простейшими примерами угловой деформации являются небольшие циклоалканы, такие как циклопропан и циклобутан, которые обсуждаются ниже. Более того, в циклических системах часто наблюдается затмение или напряжение Питцера . Эти и возможные трансаннулярные взаимодействия были ранее обобщены Х.С. Брауном как внутренний штамм или I-штамм. Подходы молекулярной механики или силового поля позволяют рассчитать такие вклады деформации, которые затем могут быть коррелированы, например, со скоростями реакции или состояниями равновесия. Многие реакции алициклических соединений, включая равновесные, окислительно-восстановительные реакции и реакции сольволиза, которые все характеризуются переходом между sp2- и sp3-состояниями в реакционном центре, коррелируют с соответствующими разностями энергии деформации SI (sp2 -sp3). Данные отражают в основном неблагоприятные вицинальные углы в средних кольцах, что иллюстрируется резким увеличением скорости восстановления кетонов с увеличением SI (рис. 1). Другим примером является сольволиз тозилатов-мостиков со стерическими разностями энергий между соответствующими производными бромида (sp3) и ионом карбения в качестве sp2-модели переходного состояния. (Фигура 2)
| Размер кольца | Энергия деформации (ккал · моль -1 ) | Размер кольца | Энергия деформации (ккал · моль -1 ) | |
|---|---|---|---|---|
| 3 | 27,5 | 10 | 12,4 | |
| 4 | 26,3 | 11 | 11,3 | |
| 5 | 6.2 | 12 | 4.1 | |
| 6 | 0,1 | 13 | 5.2 | |
| 7 | 6.2 | 14 | 1.9 | |
| 8 | 9,7 | 15 | 1.9 | |
| 9 | 12,6 | 16 | 2.0 |
В принципе угловая деформация может происходить в ациклических соединениях, но это явление встречается редко.
Маленькие кольца
Циклогексан считается эталоном для определения деформации кольца в циклоалканах, и общепринято считать, что энергия деформации практически отсутствует. Для сравнения, циклоалканы меньшего размера имеют гораздо более высокую энергию из-за повышенной деформации. Циклопропан аналогичен треугольнику и, таким образом, имеет валентные углы 60 °, что намного меньше, чем предпочтительные 109,5 ° для sp 3 -гибридизированного углерода. Кроме того, атомы водорода в циклопропане не учитываются. Циклобутан испытывает аналогичную деформацию с валентными углами примерно 88 ° (он не полностью плоский) и затмевает атомы водорода. Энергия деформации циклопропана и циклобутана составляет 27,5 и 26,3 ккал моль -1 соответственно. Циклопентан испытывает гораздо меньшую деформацию, в основном из-за деформации скручивания от затменных водородов, и имеет энергию деформации 6,2 ккал моль -1 .
Кольцевая деформация может быть значительно выше в бициклических системах . Например, бициклобутан , C 4 H 6 , известен как одно из наиболее напряженных соединений, которые можно выделить в больших масштабах; его энергия деформации оценивается в 63,9 ккал моль -1 (267 кДж моль -1 ).
Трансаннулярная деформация
Кольца среднего размера (7–13 атомов углерода) испытывают большую энергию деформации, чем циклогексан, в основном из-за отклонения от идеальных вицинальных углов или деформации Питцера. Расчеты молекулярной механики показывают, что трансаннулярная деформация, также известная как деформация Прелога , не играет существенной роли. Однако трансаннулярные реакции, такие как 1,5-сдвиги в реакциях замещения циклооктана, хорошо известны.
Бициклические системы
Количество энергии деформации в бициклических системах обычно является суммой энергии деформации в каждом отдельном кольце. Это не всегда так, поскольку иногда соединение колец вызывает дополнительную нагрузку.
Напряжение в аллостерических системах
В синтетических аллостерических системах обычно есть два или более конформера с различиями в стабильности из-за вкладов деформации. Положительная кооперативность, например, является результатом повышенного связывания субстрата A с конформером C2, который продуцируется связыванием эффекторной молекулы E. Если конформер C2 имеет такую же стабильность, как другой уравновешивающий конформер C1, подгонка, вызванная субстратом A, приведет к связывание A с C2 также в отсутствие эффектора E. Только если стабильность конформера C2 значительно меньше, что означает, что в отсутствие эффектора E популяция C2 намного меньше, чем популяция C1, соотношение K2 / K1 который измеряет эффективность аллостерического сигнала, возрастет. Отношение K2 / K1 может быть напрямую связано с разностью энергий деформации между конформерами C1 и C2; если он небольшой, более высокие концентрации A будут напрямую связываться с C2 и сделать эффектор E неэффективным. Кроме того, время отклика таких аллостерических переключателей зависит от деформации состояния межконверсионных переходов конформера.