Остаточная дипольная связь - Residual dipolar coupling
Остаточные дипольное сцепление между двумя спинами в молекуле возникает , если молекулы в растворе демонстрируют частичное выравнивание , ведущее к неполному усреднения пространственно - анизотропных дипольным муфт .
Частичное выравнивание молекул приводит к неполному усреднению анизотропных магнитных взаимодействий, таких как магнитное диполь-дипольное взаимодействие (также называемое дипольным взаимодействием), анизотропия химического сдвига или электрическое квадрупольное взаимодействие. Возникающие в результате так называемые остаточные анизотропные магнитные взаимодействия становятся все более важными в биомолекулярной ЯМР-спектроскопии .
История и новаторские работы
Спектроскопия ЯМР в частично ориентированных средах была впервые открыта в 1963 году, и только год спустя в очень фундаментальной статье Альфред Заупе смог представить основную теорию для описания и понимания наблюдаемых явлений. После этого было сообщено о большом количестве спектров ЯМР в различных жидкокристаллических фазах (см., Например ).
Второй метод частичного выравнивания, который не ограничен минимальной анизотропией, - это выравнивание, вызванное деформацией в геле (SAG), основанное на новаторской работе Deloche и Samulski. Этот метод широко использовался для изучения свойств полимерных гелей с помощью дейтериевого ЯМР высокого разрешения, но только недавно было использовано выравнивание геля для индукции RDC в молекулах, растворенных в геле. SAG позволяет неограниченное масштабирование выравнивания в широком диапазоне и может использоваться как для водных, так и для органических растворителей, в зависимости от используемого полимера. В качестве первого примера в органических растворителях, измерения RDC в гелях растянутого полистирола (PS), набухших в CDCl 3, были представлены как многообещающий метод выравнивания.
В 1995 году Джеймс Х. Престегард и его коллеги продемонстрировали, что спектры ЯМР некоторых белков (в данном случае цианометмиоглобина, который имеет очень сильно анизотропную парамагнитную восприимчивость), полученные в очень сильном поле, могут содержать данные, которые могут эффективно дополнять NOE при определении третичного состояния. складывать.
В 1996 и 1997 годах Адриан Бакс и его коллеги измерили RDC в диамагнитном белке ( убиквитине ). Результаты хорошо согласуются с кристаллическими структурами.
Физика
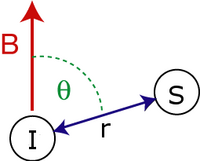
Светский дипольные сцепления гамильтониана двух спинов , и определяются по формуле:
куда
- - приведенная постоянная Планка .
- и - гиромагнитные отношения спина и спина соответственно.
- - межспиновое расстояние.
- - угол между вектором между спинами и внешним магнитным полем .
- и - векторы спиновых операторов .
Приведенное выше уравнение можно переписать в следующем виде:
куда
В изотропном растворе молекулярная галтовка снижает среднее значение до нуля. Таким образом, мы не наблюдаем диполярной связи. Если решение не изотропно, то среднее значение может отличаться от нуля, и могут наблюдаться остаточные связи.
Обратите внимание, что остаточная диполярная связь может быть положительной или отрицательной, в зависимости от диапазона углов, которые выбираются.
Помимо статического расстояния и угловой информации, RDC могут содержать информацию о внутреннем движении молекулы. Каждому атому в молекуле можно сопоставить тензор движения B , который может быть вычислен из RDC в соответствии со следующим соотношением:
где A - тензор выравнивания молекул . Строки B содержат тензоры движения для каждого атома. Тензоры движения также имеют пять степеней свободы . Из каждого тензора движения можно вычислить 5 интересующих параметров. Переменные S i 2 , η i , α i , β i и γ i используются для обозначения этих 5 параметров для атома i. S i 2 - величина движения атома i; η i - мера анизотропии движения атома i; α i и β i связаны с полярными координатами связующего вектора, выраженного в исходной произвольной системе отсчета (то есть кадре PDB). Если движение атома анизотропно (т. Е. Η i = 0), последний параметр γ i измеряет основную ориентацию движения.
Обратите внимание, что параметры движения, полученные с помощью RDC, являются локальными измерениями.
Измерение
Любое измерение RDC в растворе состоит из двух этапов, согласования молекул и исследований ЯМР:
Методы выравнивания молекул
Для диамагнитных молекул при умеренной напряженности поля молекулы не имеют большого предпочтения в ориентации, колебания образуют почти изотропное распределение, а среднее значение диполярного взаимодействия стремится к нулю. Фактически, большинство молекул имеют предпочтительную ориентацию в присутствии магнитного поля, потому что большинство из них имеют тензоры анизотропной магнитной восприимчивости .
Метод наиболее подходит для систем с большими значениями тензора магнитной восприимчивости. Сюда входят: комплекс белок-нуклеиновая кислота, нуклеиновые кислоты , белки с большим количеством ароматических остатков, порфиринсодержащие белки и связывающие металлы белки (металл может быть заменен лантаноидами ).
Для полностью ориентированной молекулы диполярное взаимодействие для амидной группы 1 H- 15 N будет более 20 кГц , а пара протонов, разделенных на 5 Å, будет иметь связь до ~ 1 кГц. Однако степень выравнивания, достигаемая приложением магнитного поля, настолько мала, что самые большие дипольные связи 1 H- 15 N или 1 H- 13 C имеют <5 Гц. Поэтому было разработано много разных сред для выравнивания:
- Липидные бицеллы (с большой магнитной восприимчивостью): измеренные RDC были порядка сотен Гц.
- Жидкокристаллические бицеллы: измеренные значения RDC составляли от -40 до +20 Гц.
- Палочковидные вирусы, в том числе нитчатые бактериофаги (большая анизотропная магнитная восприимчивость).
- ДНК-нанотрубки (совместимы с детергентами, используемыми для солюбилизации мембранных белков)
ЯМР эксперименты
Существует множество методов, которые были разработаны для точного измерения константы связи между ядрами. Они были разделены на две группы: методы на основе частоты, в которых разделение центров пиков (расщепление) измеряется в частотной области, и методы на основе интенсивности, в которых связь извлекается из интенсивности резонанса вместо разделения. Эти два метода дополняют друг друга, поскольку каждый из них подвержен различным систематическим ошибкам. Вот типичные примеры экспериментов ЯМР, принадлежащих каждой из двух групп:
- Методы интенсивности : эксперимент с количественной J-модуляцией и методы фазовой модуляции
- частотные разрешенные методы : SCE- HSQC , E. УЮТНЫЙ и спинового состояния селективные эксперименты
Структурная биология
Измерение RDC предоставляет информацию о глобальном сворачивании белка или белкового комплекса. В отличие от традиционных определений структуры ЯМР на основе NOE , RDC предоставляют структурную информацию на большом расстоянии. Он также предоставляет информацию о динамике молекул во временном масштабе, меньшем, чем наносекунды.
Исследования биомолекулярной структуры
Большинство ЯМР-исследований структуры белка основано на анализе ядерного эффекта Оверхаузера , NOE, между различными протонами в белке. Поскольку NOE зависит от инвертированной шестой степени расстояния между ядрами, r −6 , NOE могут быть преобразованы в ограничения расстояния, которые можно использовать в расчетах структур молекулярной динамики . RDC обеспечивают ограничения ориентации, а не ограничения расстояния, и имеют несколько преимуществ перед NOE:
- RDC дают информацию об угле относительно внешнего магнитного поля, что означает, что он может дать информацию об относительной ориентации частей молекулы, которые находятся далеко друг от друга в структуре.
- В больших молекулах (> 25 кДа) часто бывает трудно зарегистрировать NOE из-за спиновой диффузии . Это не проблема RDC.
- Анализ большого количества ННЭ может занять очень много времени.
При условии, что доступен очень полный набор RDC, для нескольких модельных систем было продемонстрировано, что молекулярные структуры могут быть рассчитаны исключительно на основе этих анизотропных взаимодействий, без использования ограничений NOE. Однако на практике это недостижимо, и RDC используется в основном для уточнения структуры, определяемой данными NOE и J-связью . Одна проблема с использованием диполярной связи при определении структуры состоит в том, что дипольная связь не описывает однозначно ориентацию межъядерного вектора. Более того, если доступен очень небольшой набор диполярных муфт, уточнение может привести к структуре хуже, чем исходная. Для белка с N аминокислотами ограничение 2N RDC для остова является минимумом, необходимым для точного уточнения.
Информационное содержание отдельного измерения RDC для определенного вектора связи (такого как конкретная связь NH в основной цепи в молекуле белка) можно понять, показав целевую кривую, которая прослеживает направления идеального соответствия между наблюдаемым значением RDC и рассчитанным значением. от модели. Такая кривая (см. Рисунок) имеет две симметричные ветви, лежащие на сфере с полярной осью вдоль направления магнитного поля. Их высота от экватора сферы зависит от величины значения RDC, а их форма зависит от «ромбичности» (асимметрии) тензора выравнивания молекул. Если бы молекулярное выравнивание было полностью симметричным относительно направления магнитного поля, целевая кривая просто состояла бы из двух кругов под тем же углом от полюсов, что и угол, который специфический вектор связи образует с приложенным магнитным полем.
В случае удлиненных молекул, таких как РНК , где информации о локальном скручивании и коротких расстояниях недостаточно для ограничения структур, измерения RDC могут предоставить информацию об ориентации конкретных химических связей в нуклеиновой кислоте относительно единой системы координат. В частности, молекулы РНК протона Бедные и перекрытие рибозы резонансов делают его очень трудно использовать J-соединения и NOE данные , чтобы определить структуру. Более того, могут быть обнаружены КРД между ядрами на расстоянии более 5-6 Å. Это расстояние слишком велико для генерации сигнала NOE. Это потому, что RDC пропорционален r −3, тогда как NOE пропорционален r −6 .
Измерения RDC также оказались чрезвычайно полезными для быстрого определения относительной ориентации единиц известных структур в белках. В принципе, ориентация структурной субъединицы, которая может быть такой маленькой, как виток спирали, или такой большой, как весь домен, может быть установлена всего с пяти RDC на субъединицу.
Белковая динамика
Поскольку RDC предоставляет усредненную по пространству и времени информацию об угле между внешним магнитным полем и вектором связи в молекуле, он может предоставить богатую геометрическую информацию о динамике медленных (> 10 -9 с) белков. В частности, из-за своей радиальной зависимости RDC особенно чувствителен к угловым процессам большой амплитуды. Ранний пример Tolman et al. обнаружили, что ранее опубликованные структуры миоглобина недостаточны для объяснения измеренных данных RDC, и разработали простую модель медленной динамики, чтобы исправить это. Однако для многих классов белков, включая внутренне неупорядоченные белки , анализ RDC становится более сложным, поскольку определение рамки выравнивания не является тривиальным. В двух недавних статьях описывается многообещающее решение проблемы, позволяющее обойти необходимость явного определения рамки выравнивания.
Смотрите также
- Магнитное диполь-дипольное взаимодействие
- Остаточная анизотропия химического сдвига (rCSA)
- Твердотельный ядерный магнитный резонанс (ssNMR)
использованная литература
дальнейшее чтение
Книги :
- Эмсли, JW; Линдон, Дж. Х. ЯМР-спектроскопия с использованием жидкокристаллических растворителей; Pergamon Press: Оксфорд, Великобритания, 1975.
Обзорные статьи :
- Ад Бакс и Александр Гришаев, Современное мнение в структурной биологии , 15: 563–570 (2005)
- Ребекка С. Липсиц и Нико Тьяндра, Анну. Rev. Biophys. Biomol. Struct . 33: 387–413 (2004).
Классические бумаги :
- Saupe, A .; Энглерт, Г. (1963). «Спектры ядерного магнитного резонанса высокого разрешения ориентированных молекул». Письма с физическим обзором . 11 (10): 462–464. Bibcode : 1963PhRvL..11..462S . DOI : 10.1103 / physrevlett.11.462 .
- Saupe, А (1964). "Kernresonanzen in kristallinen Flüssigkeiten und in kristallinflüssigen Lösungen. Teil I". Zeitschrift für Naturforschung . 19а (2): 161–171. Bibcode : 1964ZNatA..19..161S . DOI : 10.1515 / зна-1964-0201 . S2CID 94943333 .
- Deloche, B .; Самульский, ET (1981). «Ближний нематический ориентационный порядок в напряженных эластомерах: исследование магнитного резонанса дейтерия». Макромолекулы . 14 (3): 575–581. Bibcode : 1981MaMol..14..575D . DOI : 10.1021 / ma50004a024 .
- Тяндра, Нико; Бакс, Ад (1997). «Прямое измерение расстояний и углов в биомолекулах методом ЯМР в разбавленной жидкокристаллической среде». Наука . 278 (5340): 1111–1114. Bibcode : 1997Sci ... 278.1111T . DOI : 10.1126 / science.278.5340.1111 . PMID 9353189 .
- Tjandra, N .; Омичинский, JG; Гроненборн, AM; Clore, GM; Бакс, А. (1997). «Использование диполярных связей 1H – 15N и 1H – 13C в определении структуры магнитоориентированных макромолекул в растворе». Структурная биология природы . 4 (9): 732–738. DOI : 10.1038 / nsb0997-732 . PMID 9303001 . S2CID 22357937 .
- Tjandra, N .; Бакс, А. (1997). «Измерение дипольных вкладов в расщепления 1JCH по зависимости J-модуляции от магнитного поля в двумерных спектрах ЯМР». J. Magn. Резон . 124 (2): 512–515. Bibcode : 1997JMagR.124..512T . DOI : 10,1006 / jmre.1996.1088 . PMID 9169226 .
- Толман-младший; и другие. (1997). «ЯМР доказательства медленных коллективных движений цианометмиоглобина». Структурная биология природы . 4 (4): 292–297. DOI : 10.1038 / nsb0497-292 . PMID 9095197 . S2CID 29605996 .
- Толман-младший; Престегард, Дж. Х (1996). «Количественный J-корреляционный эксперимент для точного измерения односвязных амид15N – 1H сочетаний в белках». J. Magn. Резон. B . 112 (3): 245–252. Bibcode : 1996JMRB..112..245T . DOI : 10,1006 / jmrb.1996.0138 . PMID 8921605 .
- Толман-младший; Фланаган, Дж. М.; Кеннеди, Массачусетс; Престегард, Дж. Х (1995). «Ядерные магнитные дипольные взаимодействия в полевых белках: информация для определения структуры в растворе» . Proc. Natl. Акад. Sci. США . 92 (20): 9279–9283. Bibcode : 1995PNAS ... 92.9279T . DOI : 10.1073 / pnas.92.20.9279 . PMC 40968 . PMID 7568117 .
- Clore, GM (2000). «Точная и быстрая стыковка белок-белковых комплексов на основе данных по усилению межмолекулярных ядер по Оверхаузеру и диполярных связей путем минимизации твердого тела» . Proc. Natl. Акад. Sci. США . 97 (16): 9021–9025. Bibcode : 2000PNAS ... 97.9021C . DOI : 10.1073 / pnas.97.16.9021 . PMC 16814 . PMID 10922057 .
- Сандерс, CR; Заяц, Би Джей; Ховард, КП; Престегард, JH (1994). «Магнитно-ориентированные фосфолипидные мицеллы как инструмент для изучения мембранно-ассоциированных молекул». Прог. Nucl. Magn. Резон. Spectrosc . 26 : 421–444. DOI : 10.1016 / 0079-6565 (94) 80012-X .
- Бастиан, EW; Maclean, C .; Ван Зейл, PCM; Ботнер-Би, AA (1987). "ЯМР высокого разрешения жидкостей и газов: эффекты индуцированного магнитным полем молекулярного выравнивания". Анну. Rep. ЯМР Spectrosc . Годовые отчеты по ЯМР-спектроскопии. 19 : 35–77. DOI : 10.1016 / s0066-4103 (08) 60245-8 . ISBN 9780125053198.




![{\ displaystyle H _ {\ mathrm {D}} = {\ frac {\ hbar ^ {2} \ gamma _ {I} \ gamma _ {S}} {4 \ pi r_ {IS} ^ {3}}} [ 1-3 \ cos ^ {2} \ theta] (3I_ {z} S_ {z} - {\ vec {I}} \ cdot {\ vec {S}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/64cb9a1de4ac67a4d920322838be224b4330f0b2)








![H _ {{\ mathrm {D}}} = D _ {{IS}} (\ theta) [2I_ {z} S_ {z} - (I_ {x} S_ {x} + I_ {y} S_ {y}) ] \!](https://wikimedia.org/api/rest_v1/media/math/render/svg/f1ef53aaf415fafa421f740336087b2fe905859d)
![{\ displaystyle D_ {IS} (\ theta) = {\ frac {\ hbar ^ {2} \ gamma _ {I} \ gamma _ {S}} {4 \ pi r_ {IS} ^ {3}}} [ 1-3 \ cos ^ {2} \ theta]. \!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5304d624d47f35b40cf0fcb7e7cb645a5339c377)



