Проколлаген-пролиндиоксигеназа - Procollagen-proline dioxygenase
| Проколлаген-пролиндиоксигеназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
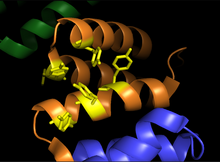
 Альфа-субъединицы проколлаген-пролиндиоксигеназы. Изображение показывает область связывания субстрата (оранжевый) и бороздку связывания остатков тирозина (желтый).
| |||||||||
| Идентификаторы | |||||||||
| ЕС нет. | 1.14.11.2 | ||||||||
| № CAS | 9028-06-2 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | Amigo / QuickGO | ||||||||
| |||||||||
Проколлаген-пролиндиоксигеназа , широко известная как пролилгидроксилаза , является членом класса ферментов, известных как альфа-кетоглутарат-зависимые гидроксилазы . Эти ферменты катализируют включение кислорода в органические субстраты по механизму, который требует альфа-кетоглутаровой кислоты , Fe 2+ и аскорбата . Этот конкретный фермент катализирует образование (2 S , 4 R ) -4-гидроксипролина , соединения, которое представляет собой наиболее распространенную посттрансляционную модификацию протеома человека .
Ферментный механизм
Проколлаген-пролиндиоксигеназа катализирует следующую реакцию:
L-пролин + альфа-кетоглутаровая кислота + O 2 → (2 S , 4 R ) -4-гидроксипролин + сукцинат + CO 2
Механизм реакции похож на других диоксигеназ, и происходит в две стадии: Во-первых, высокой реакционной способностью Fe (IV) , = O видов производится. Молекулярный кислород связан концами в аксиальном положении, образуя дикислородную единицу. Нуклеофильная атака на C2 генерирует тетраэдрический промежуточный продукт с потерей двойной связи в дикислородной единице и связями с железом и альфа-углеродом 2-оксоглутарата. Последующее удаление CO 2 совпадает с образованием частиц Fe (IV) = O. Второй этап включает в себя абстракцию про - R атома водорода от С-4 подложки пролина с последующей радикальной комбинацией, что дает гидроксипролина.
Вследствие механизма реакции одна молекула 2-оксоглутарата декарбоксилируется с образованием сукцината. Этот сукцинат гидролизуется и заменяется другим 2-оксоглутаратом после каждой реакции, и был сделан вывод, что в присутствии 2-оксоглутарата связанный с ферментом Fe 2+ быстро превращается в Fe 3+ , что приводит к инактивации фермента. Аскорбат используется в качестве кофактора для восстановления Fe 3+ до Fe 2+ .
Структура фермента
Пролилгидроксилаза представляет собой тетрамер с 2 уникальными субъединицами. Субъединица α составляет 59 кДа и отвечает как за связывание пептида, так и за каталитическую активность. Пептид-связывающий домен охватывает остатки 140-215 α-субъединицы и состоит из вогнутой поверхности, выстланной множеством остатков тирозина, которые благоприятно взаимодействуют с богатым пролином субстратом. Активный сайт состоит из Fe2 + связан с двумя гистидиновых остатками и одного аспартатами остатка, характеристикой общего большинства 2-оксоглутарат-зависимыми диоксигеназами. Β-субъединица 55 кДа отвечает за локализацию и удержание фермента в эндоплазматическом ретикулуме . Эта субъединица идентична ферменту, известному как протеиндисульфидизомераза .
Биологическая функция
Пролилгидроксилаза катализирует образование гидроксипролина. Модификация оказывает значительное влияние на стабильность коллагена , основной соединительной ткани человеческого тела. В частности, гидроксилирование увеличивает температуру плавления (T m ) спирального коллагена на 16 ° C по сравнению с негидроксилированным коллагеном, разница, которая позволяет белку быть стабильным при температуре тела. Из-за обилия коллагена (около одной трети общего белка) в организме человека и высокой встречаемости этой модификации в коллагене гидроксипролин в количественном отношении является наиболее распространенной посттрансляционной модификацией у людей.
Фермент специфически действует на пролин, содержащийся в мотиве X-Pro-Gly, где Pro - это пролин. Из-за такого специфического для мотивов поведения фермент также действует на другие белки, содержащие ту же последовательность. Такие белки включают , среди прочего , C1q , эластины , PrP , Argonaute 2 и конотоксины .
Актуальность болезни
Поскольку для функционирования пролилгидроксилазы необходим аскорбат в качестве кофактора, его отсутствие ставит под угрозу активность фермента. В результате сниженное гидроксилирование приводит к заболеванию, известному как цинга . Поскольку стабильность коллагена у пациентов с цингой нарушена, симптомы включают ослабление кровеносных сосудов, вызывающее пурпуру , петехии и кровоточивость десен.
Фактор, индуцируемый гипоксией (HIF), представляет собой эволюционно законсервированный фактор транскрипции, который позволяет клетке физиологически реагировать на снижение содержания кислорода. Идентифицирован класс пролилгидроксилаз, которые специфически действуют на HIF; гидроксилирование HIF позволяет расщеплять белок. На пролилгидроксилазу HIF воздействуют различные ингибиторы , предназначенные для лечения инсульта , болезней почек, ишемии , анемии и других важных заболеваний.
Альтернативные имена
- Протоколлаген гидроксилаза
- Пролилгидроксилаза
- Пролил 4-гидроксилаза
- Протоколлаген пролилгидроксилаза
использованная литература
внешние ссылки
- Проколлаген-пролин + диоксигеназа в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Fe (2+) 2-оксоглутарат-диоксигеназный домен в PROSITE