Иммуноглобулин E - Immunoglobulin E
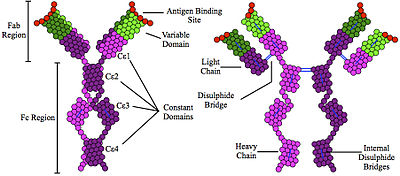
Иммуноглобулин E ( IgE ) - это тип антител (или « изотип » иммуноглобулина (Ig) ), который был обнаружен только у млекопитающих . IgE синтезируется плазматическими клетками . Мономеры IgE состоят из двух тяжелых цепей (ε-цепь) и двух легких цепей, при этом ε-цепь содержит 4 Ig-подобных константных домена (Cε1-Cε4). Считается, что IgE является важной частью иммунного ответа против заражения некоторыми паразитическими червями , включая Schistosoma mansoni , Trichinella spiralis и Fasciola hepatica . IgE также используется во время иммунной защиты от некоторых простейших паразитов, таких как Plasmodium falciparum . IgE, возможно, возник как защита от ядов.
IgE также играет важную роль в гиперчувствительности типа I , которая проявляется при различных аллергических заболеваниях, таких как аллергическая астма , большинство типов синуситов , аллергический ринит , пищевая аллергия и определенные типы хронической крапивницы и атопического дерматита . IgE также играет ключевую роль в ответах на аллергены, таких как анафилактические реакции на лекарства, укусы пчел и антигенные препараты, используемые в десенсибилизирующей иммунотерапии .
Хотя IgE обычно является наименее распространенным изотипом, уровни IgE в сыворотке крови у нормального (« неатопического ») индивидуума составляют всего 0,05% от концентрации Ig по сравнению с 75% для IgG при 10 мг / мл, которые являются изотипами. отвечает за большую часть классического адаптивного иммунного ответа - он способен вызывать анафилаксию , одну из самых быстрых и тяжелых иммунологических реакций.
Открытие
IgE был одновременно открыт в 1966 и 1967 год два независимых групп: Кимишидж Ишизак и его жена Teruko Ишизак в Исследовательском Институте детской астмы и больницах в Денвере , штат Колорадо , и SGO Йоханссон и Ганс Bennich в Упсале , Швеция . Их совместная статья была опубликована в апреле 1969 года.
Рецепторы
IgE запускает опосредованный IgE аллергический ответ путем связывания с рецепторами Fc, обнаруженными на поверхности тучных клеток и базофилов . Рецепторы Fc также обнаруживаются на эозинофилах , моноцитах , макрофагах и тромбоцитах у людей. Существует два типа рецепторов Fcε:
- FcεRI (рецептор Fcε типа I), высокоаффинный рецептор IgE
- FcεRII (рецептор Fcε типа II), также известный как CD23, рецептор IgE с низким сродством
IgE может повышать экспрессию обоих типов рецепторов Fcε. FcεRI экспрессируется на тучных клетках, базофилах и антигенпрезентирующих дендритных клетках как у мышей, так и у людей. Связывание антигенов с IgE, уже связанным FcεRI на тучных клетках, вызывает перекрестное связывание связанного IgE и агрегацию лежащего в основе FcεRI, что приводит к дегрануляции (высвобождению медиаторов) и секреции нескольких типов цитокинов типа 2, таких как интерлейкин. (IL) -3 и фактор стволовых клеток (SCF), которые помогают тучным клеткам выжить и накапливаться в ткани, а также IL-4 , IL-5 , IL-13 и IL-33 , которые, в свою очередь, активируют группу 2- врожденные лимфоидные клетки ( ILC2 или естественные клетки-помощники). Базофилы имеют общего гемопоэтического предшественника с тучными клетками; при перекрестном связывании их поверхностно связанного IgE антигенами также высвобождают цитокины 2 типа, включая IL-4 и IL-13, и другие медиаторы воспаления. Рецептор низкой аффинности (FcεRII) всегда экспрессируется на В-клетках ; но IL-4 может вызывать его экспрессию на поверхности макрофагов, эозинофилов, тромбоцитов и некоторых Т-клеток .
Функция
Гипотеза паразита
Изотип IgE эволюционировал совместно с базофилами и тучными клетками в защите от паразитов, таких как гельминты (например, Schistosoma), но также может быть эффективным при бактериальных инфекциях. Эпидемиологические исследования показывают, что уровень IgE повышается при заражении человека Schistosoma mansoni , Necator americanus и нематодами . Скорее всего, он полезен при удалении анкилостомы из легких.
Токсиновая гипотеза аллергического заболевания
В 1981 году Марджи Профет предположила, что аллергические реакции превратились в последнюю линию защиты от ядов . Хотя в то время это было спорно, новая работа поддерживает некоторые мысли Профета об адаптивной роли аллергии как защите от вредных токсинов.
В 2013 году выяснилось, что IgE-антитела играют важную роль в приобретении устойчивости к ядам медоносной пчелы и гадюки Рассела . Авторы пришли к выводу, что «небольшая доза пчелиного яда обеспечила иммунитет к гораздо большей, смертельной дозе» и «этот вид специфического для яда, IgE-ассоциированного адаптивного иммунного ответа развился, по крайней мере, в эволюционном плане, для защиты хозяина от потенциально токсичное количество яда, такое как могло бы произойти, если бы животное наткнулось на целое гнездо пчел или в случае укуса змеи ». Основной аллерген пчелиного яда ( фосфолипаза А2 ) индуцирует иммунные ответы T h 2 , связанные с выработкой антител IgE, которые могут «повышать устойчивость мышей к заражению потенциально летальными дозами».
Рак
Хотя это еще не совсем понятно, IgE может играть важную роль в распознавании рака иммунной системой , при которой может быть полезна стимуляция сильного цитотоксического ответа против клеток, отображающих только небольшое количество ранних маркеров рака. Если бы это было так, лечение анти-IgE, такое как омализумаб (от аллергии), могло бы иметь некоторые нежелательные побочные эффекты. Однако недавнее исследование, которое было проведено на основе объединенного анализа с использованием всеобъемлющих данных 67 клинических испытаний фазы I-IV омализумаба при различных показаниях, пришло к выводу, что причинно-следственная связь между терапией омализумабом и злокачественными новообразованиями маловероятна.
Роль в болезни
У людей с атопией уровень IgE в крови может быть в десять раз выше нормального (как и у людей, страдающих синдромом гипер-IgE ). Однако это может не быть требованием для появления симптомов, как это наблюдалось у астматиков с нормальным уровнем IgE в крови - недавние исследования показали, что производство IgE может происходить локально в слизистой оболочке носа.
IgE, который может специфически распознавать аллерген (обычно это белок, такой как пылевой клещ Der p 1 , кошачий Fel d 1 , пыльца травы или амброзии и т. Д.), Имеет уникальное долгоживущее взаимодействие со своим высокоаффинным рецептором FcεRI, поэтому что базофилы и тучные клетки , способные опосредовать воспалительные реакции, становятся «заряженными», готовыми выделять химические вещества, такие как гистамин , лейкотриены и некоторые интерлейкины. Эти химические вещества вызывают многие симптомы, которые мы связываем с аллергией, такие как сужение дыхательных путей при астме , местное воспаление при экземе , повышенная секреция слизи при аллергическом рините и повышенная проницаемость сосудов, что, как предполагается, позволяет другим иммунным клеткам получить доступ к тканям. , но это может привести к потенциально смертельному падению артериального давления, как при анафилаксии .
Известно, что уровень IgE повышен при различных аутоиммунных заболеваниях, таких как СКВ , ревматоидный артрит (РА) и псориаз , и теоретически имеет патогенетическое значение при СКВ и РА, вызывая реакцию гиперчувствительности.
Считается, что регуляция уровней IgE посредством контроля дифференцировки В-клеток в плазматические клетки, секретирующие антитела, включает «низкоаффинный» рецептор FcεRII или CD23 . CD23 также может способствовать облегченной презентации антигена, IgE-зависимому механизму, посредством которого B-клетки, экспрессирующие CD23 , способны представлять аллерген (и стимулировать) специфические Т-хелперные клетки , вызывая сохранение ответа T h 2, одним из отличительных признаков которого является производство большего количества антител.
Роль в диагностике
Диагностика аллергии чаще всего проводится путем изучения истории болезни человека и выявления положительного результата на наличие аллергенспецифических IgE при проведении анализа кожи или крови. Специфический тест на IgE - проверенный тест для выявления аллергии; данные не показывают, что неизбирательное тестирование на IgE или на иммуноглобулин G (IgG) может подтвердить диагноз аллергии.
Лекарства, нацеленные на путь IgE
В настоящее время аллергические заболевания и астму обычно лечат одним или несколькими из следующих препаратов: (1) антигистаминные препараты и антилейкотриены , которые противодействуют медиаторам воспаления гистамину и лейкотриенам, (2) местные или системные (пероральные или инъекционные) кортикостероиды , которые подавляют широкий спектр воспалительных механизмов, (3) бронходилататоры короткого или длительного действия , которые расслабляют гладкие мышцы суженных дыхательных путей при астме, или (4) стабилизаторы тучных клеток , которые ингибируют дегрануляцию тучных клеток, которая обычно запускается связыванием IgE при FcεRI . Известно, что длительное использование системных кортикостероидов вызывает множество серьезных побочных эффектов, и их рекомендуется избегать, если доступны альтернативные методы лечения.
IgE, путь синтеза IgE и опосредованный IgE аллергический / воспалительный путь - все они являются важными мишенями для вмешательства в патологические процессы аллергии, астмы и других заболеваний, опосредованных IgE. Путь дифференцировки и созревания B-лимфоцитов, который в конечном итоге генерирует плазматические клетки, секретирующие IgE, проходит через промежуточные стадии B-лимфобластов, экспрессирующих IgE, и включает взаимодействие с B-клетками памяти, экспрессирующими IgE. Tanox , биотехнологическая компания, базирующаяся в Хьюстоне, штат Техас, в 1987 году предложила, что, воздействуя на мембраносвязанный IgE (mIgE) на B-лимфобласты и B-клетки памяти, эти клетки можно лизировать или подавлять, тем самым достигая ингибирования продукции антиген-специфический IgE и, следовательно, сдвиг иммунного баланса в сторону механизмов, не связанных с IgE. Были разработаны два подхода, нацеленных на путь IgE, и оба они активно развиваются. В первом подходе лекарственное средство на основе антител против IgE омализумаб (торговое название Xolair ) распознает IgE, не связанный с его рецепторами, и используется для нейтрализации или поглощения существующего IgE и предотвращения его связывания с рецепторами на тучных клетках и базофилах. Xolair был одобрен во многих странах для лечения тяжелой стойкой аллергической астмы. Он также был одобрен в марте 2014 года в Европейском Союзе и США для лечения хронической спонтанной крапивницы , которую нельзя адекватно лечить с помощью H1- антигистаминных препаратов . Во втором подходе были получены антитела, специфичные к домену из 52 аминокислотных остатков, обозначаемому как CεmX или M1 '(первичный M1), присутствующим только на человеческом mIgE на В-клетках, а не на свободном растворимом IgE, и их количество ниже. клиническая разработка для лечения аллергии и астмы. Гуманизированное антитело против M1 ', квилизумаб , проходит фазу IIb клинических испытаний.
В 2002 году исследователи из отдела клеточной и молекулярной биофизики Рэндалла определили структуру IgE. Понимание этой структуры (которая нетипична для других изотипов в том смысле, что она сильно изогнута и асимметрична) и взаимодействия IgE с рецептором FcεRI позволит разработать новое поколение лекарств от аллергии, которые стремятся вмешиваться во взаимодействие IgE-рецептора. Возможно, удастся разработать методы лечения, более дешевые, чем моноклональные антитела (например, низкомолекулярные препараты), которые используют аналогичный подход для ингибирования связывания IgE с его рецептором.