Связующие молекулярные орбитали - Bonding molecular orbital
Склеивание орбитальное используются в молекулярной орбитальной теории (MO) , чтобы описать привлекательные взаимодействия между атомными орбиталями два или более атомов в молекуле. Согласно теории МО, электроны движутся волнообразно. Когда более чем одна из этих волн сближаются, синфазная комбинация этих волн создает взаимодействие, которое приводит к значительной стабилизации вида. Результат конструктивной интерференции волн приводит к тому, что плотность электронов находится в области связывания, создавая стабильную связь между двумя видами.
Двухатомные молекулы
В классическом примере МО Н 2 два отдельных атома Н имеют одинаковые атомные орбитали. При создании молекулы дигидрогена отдельные валентные орбитали, 1 с , либо: сливаются в фазе, чтобы получить связывающие орбитали, где электронная плотность находится между ядрами атомов; или слиться в противофазе, чтобы получить разрыхляющие орбитали, где электронная плотность присутствует повсюду вокруг атома, за исключением пространства между ядрами двух атомов. Связующие орбитали приводят к более стабильным видам, чем когда два атома водорода являются одноатомными. Разрыхляющие орбитали менее стабильны, потому что при очень небольшой электронной плотности в середине или ее отсутствии два ядра (с одинаковым зарядом) отталкиваются друг от друга. Следовательно, потребуется больше энергии, чтобы удерживать два атома вместе через разрыхляющую орбиталь. Каждый электрон в валентности 1 с оболочкой водорода объединяется , чтобы заполнить стабилизирующую связывающую орбиталь. Итак, водород предпочитает существовать в виде двухатомной, а не одноатомной молекулы.
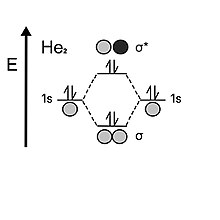
Глядя на гелий, атом содержит два электрона в каждой валентной 1 s- оболочке. Когда две атомные орбитали сходятся вместе, они сначала заполняют связывающую орбиталь двумя электронами, но, в отличие от водорода, у него осталось два электрона, которые затем должны перейти на разрыхляющую орбиталь. Нестабильность разрыхляющей орбитали нейтрализует стабилизирующий эффект, обеспечиваемый связывающей орбиталью; следовательно, порядок связи дигелия равен 0. Вот почему гелий предпочел бы быть одноатомным, а не двухатомным.
Многоатомные молекулы
Скрепление МО пи-облигаций
Связи Pi создаются «боковыми» взаимодействиями орбиталей. Еще раз, на молекулярных орбиталях связывание пи (π) электронов происходит, когда взаимодействие двух атомных орбиталей π синфазно. В этом случае электронная плотность π-орбиталей должна быть симметричной вдоль плоскости зеркала, чтобы создать связывающее взаимодействие. Асимметрия вдоль плоскости зеркала приведет к узлу в этой плоскости и описывается разрыхляющей орбиталью π *.
Примером МО простой сопряженной π-системы является бутадиен. Чтобы создать МО для бутадиена , результирующие π- и π * -орбитали ранее описанной системы будут взаимодействовать друг с другом. Это смешивание приведет к созданию 4 групповых орбиталей (которые также можно использовать для описания π МО любого диена): π 1 не содержит вертикальных узлов , π 2 содержит один, и обе считаются связывающими орбиталями; π 3 содержит 2 вертикальных узла, π 4 содержит 3 и оба считаются разрыхляющими орбиталями.
Локализованные молекулярные орбитали
Сферическая трехмерная форма s- орбиталей не имеет направленности в пространстве, а орбитали p x , p y и p z находятся под углом 90 o относительно друг друга. Поэтому, чтобы получить орбитали, соответствующие химическим связям, для описания химических реакций, Эдмистон и Рюденберг первыми разработали процедуры локализации. Например, в CH 4 четыре электрона с орбиталей 1 s атомов водорода и валентные электроны атома углерода (2 на s и 2 на p ) занимают связывающие молекулярные орбитали, σ и π. Делокализованные МО атома углерода в молекуле метана затем могут быть локализованы с образованием четырех гибридных sp 3 орбиталей .
Приложения
Молекулярные орбитали и, более конкретно, связывающая орбиталь - это теория, которая преподается во всех различных областях химии, от органической до физической и даже аналитической, поскольку она широко применима. Химики-органики используют теорию молекулярных орбиталей в своем мысленном обосновании реакций; химики-аналитики используют его в различных методах спектроскопии; физико-химики используют его в расчетах; это даже наблюдается в химии материалов через зонную теорию - расширение теории молекулярных орбиталей.
использованная литература
- ^ Малликен, Роберт С. (1932). «Электронные структуры многоатомных молекул и валентность. II. Общие положения». Физический обзор . 41 (1): 49–71. Полномочный код : 1932PhRv ... 41 ... 49M . DOI : 10.1103 / Physrev.41.49 .
- ^ Санниграхи, AB; Кар, Тапас (1988-08-01). «Молекулярная орбитальная теория порядка и валентности связи». Журнал химического образования . 65 (8): 674. Bibcode : 1988JChEd..65..674S . DOI : 10.1021 / ed065p674 . ISSN 0021-9584 .
- ^ a b c d e 1960-, Анслин, Эрик В. (2006). Современная физическая органическая химия . Догерти, Деннис А., 1952-. Саусалито, Калифорния: Университетская наука. ISBN 978-1891389313. OCLC 55600610 .CS1 maint: числовые имена: список авторов ( ссылка )
- ^ Леннард-Джонс, JE (1929-01-01). «Электронное строение некоторых двухатомных молекул». Труды общества Фарадея . 25 : 668. Bibcode : 1929FaTr ... 25..668L . DOI : 10.1039 / tf9292500668 . ISSN 0014-7672 .
- ^ Housecroft, Екатерина Е. (2012). Неорганическая химия . Шарп, AG (4-е изд.). Харлоу, Англия: Пирсон. ISBN 9780273742753. OCLC 775664094 .
- ^ а б Коэн, Ирвин; Дель Бене, Джанет (1969-08-01). «Гибридные орбитали в теории молекулярных орбиталей». Журнал химического образования . 46 (8): 487. Bibcode : 1969JChEd..46..487C . DOI : 10.1021 / ed046p487 . ISSN 0021-9584 .
- ^ Эдмистон, Клайд (1963). «Локализованные атомные и молекулярные орбитали». Обзоры современной физики . 35 (3): 457–464. Bibcode : 1963RvMP ... 35..457E . DOI : 10,1103 / revmodphys.35.457 .
- ^ a b Данненберг, JJ (1999-05-12). «Использование теории возмущений и пограничных молекулярных орбиталей для прогнозирования диастереофациальной селективности». Химические обзоры . 99 (5): 1225–1242. DOI : 10.1021 / cr980382f . ISSN 0009-2665 . PMID 11749445 .
- ^ Ли, Юнцзюнь; Цзя, Чжиюй; Сяо, Шэнцян; Лю, Huibiao; Ли, Юлян (2016-05-16). «Метод управления синтезом стабильных скрученных двумерных сопряженных молекул» . Nature Communications . 7 : 11637. Bibcode : 2016NatCo ... 711637L . DOI : 10.1038 / ncomms11637 . PMC 4873669 . PMID 27181692 .
- ^ Смит, Венделл Ф. (1963). «Применение теории молекулярных орбиталей к электронным спектрам поглощения шиффовых оснований». Тетраэдр . 19 (3): 445–454. DOI : 10.1016 / s0040-4020 (01) 99192-6 .
- ^ Малликен, Роберт С. (1967-07-07). «Спектроскопия, молекулярные орбитали и химическая связь». Наука . 157 (3784): 13–24. Bibcode : 1967Sci ... 157 ... 13M . DOI : 10.1126 / science.157.3784.13 . ISSN 0036-8075 . PMID 5338306 .
- ^ Gimarc, Бенджамин М. (1974). «Приложения качественной теории молекулярных орбиталей». Счета химических исследований . 7 (11): 384–392. DOI : 10.1021 / ar50083a004 .
- ^ Brédas, JL; Calbert, JP; да Силва Филью, DA; Корнил, Дж. (30 апреля 2002 г.). «Органические полупроводники: теоретическая характеристика основных параметров, определяющих перенос заряда» . Труды Национальной академии наук . 99 (9): 5804–5809. Bibcode : 2002PNAS ... 99.5804B . DOI : 10.1073 / pnas.092143399 . PMC 122857 . PMID 11972059 .