Эпоксидирование Ши - Shi epoxidation
Эпоксидировании Ши является химической реакция описана как асимметричное эпоксидирование из алкенов с оксон (калий пероксимоносульфат) и фруктоза -derived катализатором ( 1 ). Считается, что эта реакция протекает через промежуточный диоксиран , образованный из кетона катализатора оксоном (пероксимоносульфатом калия). Добавление сульфатной группы к оксону облегчает образование диоксирана, действуя как хорошая уходящая группа во время замыкания цикла. Он примечателен использованием неметаллического катализатора и представляет собой ранний пример органокатализа . Впервые реакцию обнаружил Янь Ши (史一安, pinyin : Shǐ Yī-ān) из Университета штата Колорадо в 1996 году.
Краткая историческая справка
До того, как он был открыт, было предпринято множество попыток синтеза эффективного неметаллического катализатора. Проблема с предыдущими катализаторами заключалась в быстром разложении / окислении промежуточного диоксирана и отсутствии электрофильности реакционноспособного кетона. Были предложены ароматические кетоны, и были использованы многие последующие варианты солей оксоаммония , но они оказались неэффективными для стимуляции эпоксидирования из-за окислительной нестабильности амидных групп и высокой гибкости семичленных колец. Энантиоселективность этих ранних катализаторов была также снижена из-за больших расстояний между асимметричными субъединицами и реакционными центрами, что давало энантиомерный избыток менее 10 процентов .
Катализатор, открытый группой Янь Ши в 1996 году, был получен из D-фруктозы и имеет стереогенный центр, близкий к реакционному центру (кетону) - жесткая шестичленная кольцевая структура катализатора и соседняя четвертичная кольцевая группа минимизируют эпимеризацию этого стереоцентра. . Окисление активным диоксирановым катализатором происходит с боковой поверхности из-за стерических затруднений противоположной поверхности. Этот катализатор эффективно действует как асимметричный катализатор нефункционализированных транс-олефинов.
Образование диоксиранового катализатора.
В условиях нормального pH требуется избыток кетонового катализатора в 3 стехиометрических количества из-за высокой скорости разложения. При основных условиях pH выше 10 (pH 10,5) для эпоксидирования необходимы субстехиометрические количества (0,2-0,3), снижающие разложение реагентов за счет предотвращения побочной реакции Байера-Виллигера. Более высокие температуры приводят к дальнейшему разложению; таким образом, используется низкая температура, равная нулю градусов Цельсия.
Разложение реагентов бимолекулярное ( скорость реакции второго порядка ), поэтому используются небольшие количества оксона и катализатора.
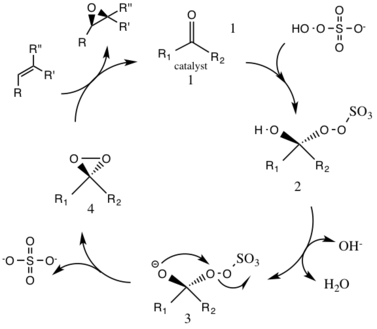
Реакция опосредуется катализатором, полученным из D-фруктозы, который дает (R, R) энантиомер полученного эпоксида. Растворимость олефинового органического субстрата и окислителя (оксона) различается, поэтому необходима двухфазная среда. Генерация активных частиц катализатора происходит в водном слое и перемещается в органический слой с реагентами сульфатом тетрабутиламмония. Кетоновый катализатор непрерывно регенерируется в каталитическом цикле и, таким образом, может катализировать эпоксидирование в небольших количествах.
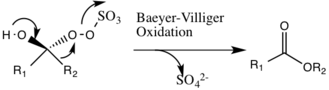
Первым этапом реакции каталитического цикла является реакция нуклеофильного присоединения оксона к кетонной группе на катализаторе (промежуточное соединение 1). При этом образуется химически активный промежуточный продукт номер 2, промежуточный продукт Криджи, который потенциально может привести к нежелательным побочным реакциям, таким как реакция Байера-Виллигера (см. Ниже). Образование промежуточных частиц номер 3 происходит в основных условиях с удалением водорода из гидроксигруппы с образованием нуклеофильного аниона кислорода. Сульфатная группа способствует последующему образованию диоксирана, промежуточного вида номер 4, действуя как хорошая уходящая группа во время 3-экзо-тригциклизации . Затем активированный диоксирановый каталитический компонент переносит атом кислорода на алкен, что приводит к регенерации исходного катализатора.
Побочные реакции
Потенциальной побочной реакцией, которая может происходить, является реакция Байера-Виллигера промежуточного соединения 2, где происходит перегруппировка пероксигруппы, которая приводит к образованию соответствующего сложного эфира. Степень этой побочной реакции снижается с повышением pH и увеличивает нуклеофильность оксона, делая основные условия благоприятными для общего эпоксидирования и реакционной способности каталитических частиц.
Механизм эпоксидирования
Кислород из диоксирановой группы, образующийся на органическом катализаторе, переносится на алкен, что считается согласованным механизмом, хотя присутствие промежуточного кислородного аниона через механизм S n 2 может проявляться.
Получение производного D-фруктозы
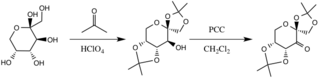
Катализатор образуется в результате реакции с ацетоном в основных условиях, при этом гидроксильные группы фруктозного кольца действуют как нуклеофилы, их нуклеофильность увеличивается за счет основных условий, создаваемых карбонатом калия . Электроноакцепторные заместители (альфа-эфирные группы) способствуют образованию кетона из окислителя хлорхромата пиридиния за счет увеличения электрофильности карбонильного углерода через стабилизирующую делокализацию образующихся π CC-связей в σ * CO-связи соседних эфиры.
Переходные состояния и энантиомерная селективность
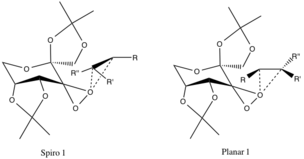
Есть два предложенных переходных состояния, геометрия которых выдумана и не подтверждена экспериментальными данными, но приписывается стереоэлектронным эффектам . Спиро-переходное состояние предпочтительнее планарного из-за несвязывающих орбиталей высшего кислорода, отдающего на π * антисвязывающие CC-орбитали реагирующего алкена, обеспечивая стабилизирующую делокализацию электронов.
Передача этих электронов в образующиеся σ-связи CO эпоксидных связей также способствует образованию спиро-продукта (геометрия продукта также выровнена). Плоская конфигурация не является предпочтительной из-за отсутствия пи-обратной связи и стерических затруднений алкильных групп с большими алкильными функциональными группами каталитического кольца.
Вышеупомянутые конфигурации предпочтительнее переходных состояний противоположных энантиомеров из-за неблагоприятных стерических взаимодействий между R-алкильными группами (см. Ниже) и простыми алкильными функциональными группами каталитического кольца.
Энантиомерный успех этого эпоксидирования относительно высок по сравнению с металлическими катализаторами и обычно приводит к высокому энантиомерному избытку, превышающему 80 процентов.
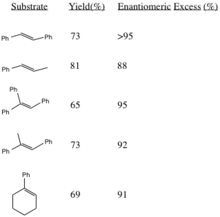
Выход реакции и стереоселективность
Эта процедура генерирует эпоксиды с высоким энантиомерным избытком из транс-дизамещенных алкенов и тризамещенных алкенов. Цис-дизамещенные алкены и стиролы асимметрично эпоксидируются с использованием аналогичного катализатора. Образование (R, R) эпоксидов из соответствующих алкенов увеличивает стереоселективность с увеличением стерического объема заместителей R-групп (особенно в транс-олефинах).
использованная литература
- ^ Эффективный метод каталитического асимметричного эпоксидированияЧжи-Сянь Ван, Юн Ту, Майкл Фрон, Цзянь-Ронг Чжан и Ян Ши Дж. Ам. Chem. Soc. 1997,119 (46), 11224-11235. (DOI:10.1021 / ja972272g)
- ^ Frohn, M .; Ши, Ю.Синтез 2000,14, 1979-2000DOI:10,1055 / с-2000-8715. (Обзор)
- ^ Тиан, H .; Она, X .; Шу, Л .; Yu, H .; Ши, Ю. Дж. Ам. Chem. Soc. 2000,122, 11551-11552. (DOI:10.1021 / ja003049d)
- ^ Тиан, H .; Она, X .; Xu, J .; Shi, Y. Org. Lett. 2001,3, 1929-1931. (DOI:10.1021 / ol010066e)
- Эпоксидирование Ши < https://www.organic-chemistry.org/ namedreactions / shi-epoxidation.shtm >
- Дания, Ву и др. "Разработка хиральных, нерацемических диоксиранов для каталитического энантиоселективного эпоксидирования алкенов". (13 апреля 1999 г.) < https://www.thieme-connect.de/products/ejournals/pdf/10.1055/s-1999-3123.pdf >
- Фрон, Ши, Ту, Ван, Чжан и др. «Эффективный метод асимметричного эпоксидирования». (8 июля 1997 г.) < http://pubs.acs.org/doi/pdf/10.1021/ja972272g >
- Ши, Ван и др. «Новый тип кетонового катализатора для асимметричного эпоксидирования». (12 сентября 1997 г.). < http://pubs.acs.org/doi/pdf/10.1021/jo971701q >