Реакция Пикте – Шпенглера - Pictet–Spengler reaction
| Реакция Пикте-Шпенглера | |
|---|---|
| Названный в честь |
Аме Пикте Теодор Шпенглер |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Идентификатор онтологии RSC | RXNO: 0000059 |
Реакция Пикте-Шпенглера - это химическая реакция, в которой β-арилэтиламин подвергается конденсации с альдегидом или кетоном с последующим замыканием кольца. Реакция была впервые обнаружена в 1911 году Аме Пикте и Теодором Шпенглером (22 февраля 1886 - 18 августа 1965). Традиционно при нагревании использовали кислотный катализатор в протонном растворителе , однако было показано, что реакция протекает в апротонных средах с превосходными выходами и иногда без кислотного катализа . Реакцию Пикте – Шпенглера можно рассматривать как частный случай реакции Манниха , которая следует аналогичному пути реакции. Движущей силой этой реакции является электрофильность из иминия иона , генерируемого в результате конденсации альдегида и амина в кислых условиях. Это объясняет потребность в кислотном катализаторе в большинстве случаев, поскольку имин недостаточно электрофилен для замыкания цикла, но ион иминия способен вступать в реакцию.
Реакция Пикте-Шпенглера широко распространена как в промышленности, так и в биосинтезе. С момента своего создания он оставался важной реакцией в области алкалоидного и органического синтеза , где он использовался при разработке многих бета-карболинов . В естественной реакции Пикте-Шпенглера обычно используется фермент , такой как стриктозидинсинтаза . Продукты Pictet-Spengler можно выделить из многих продуктов, изначально полученных от природы, включая такие продукты питания, как соевый соус и кетчуп . В таких случаях в качестве биологического сырья обычно используются аминокислота триптофан и различные альдозы .
Нуклеофильные ароматические кольца, такие как индол или пиррол, дают продукты с высокими выходами и в мягких условиях, тогда как менее нуклеофильные ароматические кольца, такие как фенильная группа, дают более низкие выходы или требуют более высоких температур и сильной кислоты. Первоначальная реакция Пикте-Шпенглера представляла собой реакцию фенэтиламина и диметоксиметана , катализируемую соляной кислотой с образованием тетрагидроизохинолина .
Реакция Пикте – Шпенглера с большим успехом применяется в твердофазной комбинаторной химии .
Аналогичная реакция с арил-β-этанолом называется реакцией окса-Пикте – Шпенглера.
Механизм реакции
Механизм реакции происходит путем начального образования иона иминия ( 2 ) с последующим электрофильным присоединением в положении 3 в соответствии с ожидаемой нуклеофильностью индолов с образованием спироцикла 3 . После миграции лучшей мигрирующей группы депротонирование дает продукт ( 5 ).
Вариации
Синтез тетрагидроизохинолина Пикте – Шпенглера.
Замена индола на 3,4-диметоксифенильную группу дает реакцию, названную синтезом тетрагидроизохинолина Пикте-Шпенглера. Условия реакции обычно более жесткие, чем у варианта индола, и требуют условий кипячения с обратным холодильником с сильными кислотами, такими как соляная кислота , трифторуксусная кислота или суперкислоты .
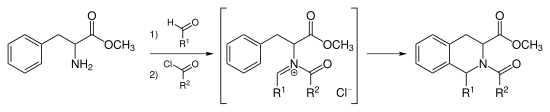
Ион N- ацилиминия реакция Пикте – Шпенглера
Вместо того, чтобы катализировать циклизацию Пикте-Шпенглера сильной кислотой, можно ацилировать иминиевый ион, образуя промежуточный ион N- ацилиминия. В N -acyliminium ион является очень мощным электрофильным и большинство ароматических кольцевых систем будут циклизации в мягких условиях с хорошими выходами.
Тадалафил синтезируется с помощью реакции Пикте-Шпенглера N- ацилиминия. Эту реакцию также могут катализировать AuCl 3 и AgOTf .
Асимметричная реакция Пикте – Шпенглера.
Когда реакция Пикте-Шпенглера проводится с альдегидом, отличным от формальдегида , создается новый хиральный центр. Было разработано несколько контролируемых субстратом или вспомогательными веществами диастереоселективных реакций Пикте-Шпенглера. Кроме того, List et al. опубликовали хиральную кислоту Бренстеда, которая катализирует асимметричные реакции Пикте-Шпенглера.
Триптофаны: диастереоконтролируемая реакция
. Реакция энантиочистого триптофана или его короткоцепочечных алкиловых эфиров приводит к 1,2,3,4-тетрагидро- β- карболинам, в которых новый хиральный центр на C-1 принимает цис- или транс- конфигурацию по направлению к С-3 карбоксильная группа. Цис проводимость кинетический контролируется, т.е. осуществляются при более низких температурах. При более высоких температурах реакция становится обратимой и обычно способствует рацемизации . 1,3- транс доминируют продукты могут быть получены с помощью N б - бензилированы триптофанов, которые доступны с помощью восстановительного аминирования . Бензильная группа может быть впоследствии удалена гидрогенолитически . Как правило, сигналы ЯМР 13 C для C1 и C3 в цис- продуктах смещены в слабое поле по сравнению с транс- продуктами (см. Эффект стерического сжатия ).