Дидемнин - Didemnin
Дидемнины представляют собой циклические депсипептидные соединения, выделенные из оболочников ( асцидий или морских брызг) рода Trididemnum (семейство Didemnidæ ), которые были собраны в Карибском море . Впервые они были изолированы в 1978 году в Университете Иллинойса .
Хотя из экстракта Trididemnum solidum было выделено более девяти дидемнинов (дидемнины AE, G, X и Y) , дидемнин B обладает наиболее сильной биологической активностью . Это сильный противовирусный агент против ДНК и РНК вирусов, таких как вирус простого герпеса типа 1 , сильный иммунодепрессант, который проявляет некоторый потенциал в кожных трансплантатах, а также очень цитотоксичен . Он проявляет сильную активность против лейкозных клеток мышей . Большие количества дидемнина были химически синтезированы и была выдвинута в клинических испытаниях со стороны Национального института рака . Она завершила Фазу II человека клинических испытаний против аденокарциномы в почках , расширенный эпителиальный рака яичников и метастатического рака молочной железы. К сожалению, это соединение проявило высокую токсичность из-за высокой частоты анафилактических реакций у пациентов, и испытания были прекращены.
Аналог дидемнина плитидепсин проходил II фазу клинических испытаний с 2003 года.
Биосинтез
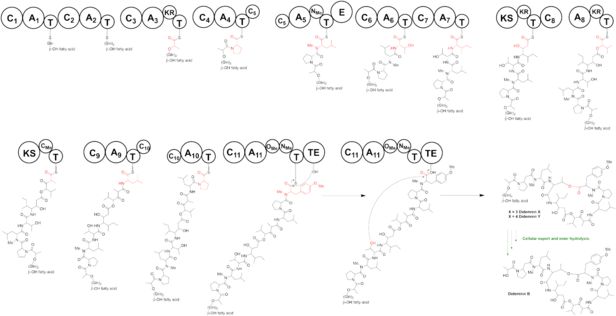
Биосинтез депсипептида дидемнина регулируется путем гибридного нерибосомного пептид-синтетаза-поликетид-синтетаза (NRPS-PKS). Дидемнин-мегасинтетаза состоит из 10 белков, из которых 8 NRPS и 2 PKS, всего 13 модулей.
Предлагаемый путь биосинтеза дидемнина B начинается на Did A. Оба модуля 1 и 2 включают глицин на β-OH жирной кислоте. На DidB домен аденилирования (A) загружается пируватом и впоследствии восстанавливается в своей цис-конформации за счет домена кеторедуктазы (KR), в результате чего образуется лактат, связанный с доменом тиолирования (T). Мономодульный didC включает пролин до того, как тридомен didD удлиняет пептидную цепь на 3 аминокислоты. Домен аденилирования (A) didD загружается лейцином, а затем N-метилируется доменом метилтрансферазы (MT) и превращается в N-метилированный D-лейцин доменом эпимеразы (E). N-метилированный лейцин является единственной D-аминокислотой в дидемнине B. Второй модуль на didD включает треонин, а третий модуль на присоединенном к домену изолейцине, собирая тетрапептид (Pro) - (N-Me-D-Leu) - (Thr) - (Иль). DidE является PKS, но в нем отсутствует домен ацилтрансферазы (AT). Модуль 8 на didE присоединяет кетид-удлиненный β-гидрокси-γ-изостатин. Предполагается, что дидемнин PKS мобилизует FabD-домен AT из синтазы жирных кислот (FAS), поскольку в геноме дидемина отсутствует AT-домен. Домен DidF A загружен 2-оксоизовалериановой кислотой и включает 2-гидроксиизовалериановую кислоту α-гидроксикислоты. Модуль 10 на PKS DidG добавляет второй раунд малонатного удлинения. Домен MT на DidG добавляет к этому остатку α-метильную группу. Мономодульные домены DidH, DidI и DidJ удлиняют цепь соответственно лейцином, пролином и тирозином. Два домена MT на DidJ дважды метилируют тирозин с образованием N-метил-O-метил-тирозина, завершая сборку линейного дидемнина B. Домен тиоэстеразы (TE) в модуле DidJ высвобождает продукт в его циклизованной форме.
Смотрите также
Рекомендации
- ^ Rinehart L., K. et al. . Варенье. Chem. Soc. 1981 , 103 , 1857–1859.
- ^ Rinehart L., K. et al. . J. Nat. Prod. 1988 , 51 , 1-21.
- ^ Монтгомери, Д .; Зукоши, CF Transplantation 1985 , 40 , 49.
- ^ Belof, J (2006). «Обзор дидемнинов: класс природных продуктов депсипептида с многообещающими биомедицинскими применениями». arXiv : q-bio / 0612040 .
- ^ Тейлор, SA; Goodman, P .; Стаки, У. Дж. Стивенс, Р. Л.; Гейнор, ER Invest. Новые лекарства 1992 , 10 , 55.
- ^ Каин, JM; Лю, ПЯ; Альберта, Делавэр; Галлион, Джей Джей; Laufman, L .; О'Салливан, Дж .; Weiss, G .; Бикерс, Дж . Н. Инвест. Новые лекарства 1992 , 10 , 113.
- ^ Монтгомери, Д .; Зукоши, CF Transplantation 1985 , 40 , 49.
- ^ Nuijen, B .; Bouma, M .; Manada, C .; Джимено, JM; Schellens, JHM; Bult, A .; Beijnen, JH Anti-Cancer Drugs 2000 , 11 , 793.
- ^ Cárdenas, F. et al . Журнал органической химии 2003 , 68 (25), 9554-9562.
- ^ Xu Y., et al. Варенье. Chem. Soc 2012 , 20 , 8625–8632. https://doi.org/10.1021/ja301735a