Деметилирование - Demethylation
Деметилирование - это химический процесс, приводящий к удалению метильной группы (CH 3 ) из молекулы. Распространенным способом деметилирования является замена метильной группы на атом водорода, что приводит к чистой потере одного атома углерода и двух атомов водорода.
Аналог деметилирования - метилирование .
В биохимии
В биохимических системах, процесс деметилирования , катализируемой с помощью деметилаз . Эти ферменты окисляют N-метильные группы, которые встречаются в гистонах и некоторых формах ДНК:
- R 2 N-CH 3 + O → R 2 N-H + CH 2 O
Одним из таких семейств окислительных ферментов является цитохром P450 . Альфа-кетоглутарат-зависимые гидроксилазы активны в деметилировании ДНК, действуя аналогичным образом. В этих реакциях используется слабая связь CH, прилегающая к аминам.
В частности, 5-метилцитозины в ДНК могут быть деметилированы ферментами TET, как показано на рисунке. Во время эмбриогенеза у мыши около 20 миллионов 5-метилцитозинов деметилируются в течение шести часов сразу после оплодотворения яйцеклетки спермой с образованием зиготы. Ферменты ТЕТ представляют собой диоксигеназы из семейства альфа-кетоглутарат-зависимых гидроксилаз . Фермент TET представляет собой зависимую от альфа-кетоглутарата (α-KG) диоксигеназу, которая катализирует реакцию окисления путем включения одного атома кислорода из молекулярного кислорода (O 2 ) в свой субстрат, 5-метилцитозин в ДНК (5mC), для получения продукта. 5-гидроксиметилцитозин в ДНК. Это преобразование сочетается с окислением вспомогательного субстрата α-KG до сукцината и диоксида углерода (см. Рисунок).
Первый шаг включает связывание α-KG и 5-метилцитозина с активным центром фермента TET. Каждый из ферментов TET имеет основной каталитический домен с двухцепочечной β-спиральной складкой, которая содержит важные металлсвязывающие остатки, обнаруженные в семействе Fe (II) / α-KG-зависимых оксигеназ. α-KG координируется как бидентатный лиганд (связанный в двух точках) с Fe (II) (см. рисунок), в то время как 5mC удерживается нековалентной силой в непосредственной близости. Активный центр TET содержит высококонсервативный мотив триады, в котором каталитически важный Fe (II) удерживается двумя остатками гистидина и одним остатком аспарагиновой кислоты (см. Рисунок). Триада связывается с одной стороной центра Fe, оставляя три лабильных сайта, доступных для связывания α-KG и O 2 (см. Рисунок). Затем TET превращает 5-метилцитозин в 5-гидроксиметилцитозин, в то время как α-кетоглутарат превращается в сукцинат и CO 2 .
Неорганическая химия
Расщепление метиловых эфиров
Деметилирование часто относится к расщеплению простых эфиров, особенно ариловых эфиров, хотя есть некоторые исключения, например см. « дезипрамин ».
Арилметиловые эфиры широко распространены в лигнине и многих производных соединениях. Деметилирование этих материалов потребовало больших усилий. Для реакции обычно требуются суровые условия или агрессивные реагенты. Например, метиловый эфир ванилина можно удалить путем нагревания до 250 ° C с сильным основанием. Более сильные нуклеофилы, такие как диорганофосфиды (LiPPh 2 ), также расщепляют ариловые эфиры в более мягких условиях. Другие использованные сильные нуклеофилы включают соли тиолатов, такие как EtSNa.
Также можно использовать кислотные условия. Исторически сложилось так, что арилметиловые эфиры, включая природные продукты, такие как кодеин ( O- метилморфин), деметилировали путем нагревания вещества в расплавленном гидрохлориде пиридина (т.пл. 144 ° C) при 180-220 ° C, иногда с избытком хлористого водорода, процесс, известный как расщепление эфира Цейзеля – Прей . Количественный анализ ароматических метиловых эфиров может быть выполнен аргентометрическим определением образовавшегося хлорида N- метилпиридиния. Механизм этой реакции начинается с переноса протона от иона пиридиния к арилметиловому эфиру, что является крайне неблагоприятным этапом ( K < 10–11 ), который объясняет требуемые жесткие условия, учитывая гораздо более слабую кислотность пиридиния (p K a = 5,2 ) по сравнению с протонированным арилметиловым эфиром (ион арилметилоксония, p K a = –6,7 для арил = Ph). За этим следует атака S N 2 иона арилметилоксония на метильную группу пиридином или ионом хлорида (в зависимости от субстрата) с образованием свободного фенола и, в конечном итоге, хлорида N- метилпиридиния, либо непосредственно, либо путем последующего переноса метила из метилхлорид в пиридин.
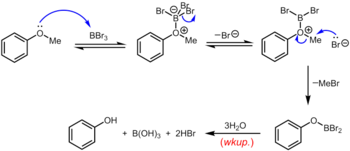
Другой классический (но опять же жесткий) метод удаления метильной группы арилметилового эфира заключается в нагревании эфира с обратным холодильником в растворе бромистого водорода или иодистого водорода в уксусной кислоте (точка кипения 118 ° C) или концентрированной бромистоводородной или бромистоводородной кислоте. йодистоводородная кислота. Расщепление простых эфиров бромистоводородной или йодистоводородной кислотой происходит по очень похожему механизму, в котором высококислотный HBr или HI служит для протонирования эфира с последующим замещением бромидом или йодидом, оба из которых являются превосходными нуклеофилами. Несколько более мягкий набор условий использует циклогексилиодид (CyI, 10,0 экв.) В N , N- диметилформамиде для образования небольшого количества иодистого водорода in situ . Трибромид бора , который можно использовать при комнатной температуре или ниже, является более специализированным реагентом для деметилирования арилметиловых эфиров. Механизм деалкилирования эфира протекает через начальное обратимое образование кислотно-основного аддукта Льюиса между сильно льюисовским BBr 3 и основным эфиром Льюиса. Этот аддукт Льюиса может обратимо диссоциировать с образованием дибромоборилоксониевого катиона и Br - . Разрыв эфирной связи происходит в результате последующей нуклеофильной атаки на оксониевые частицы со стороны Br - с образованием арилоксидибромоборана и бромистого метила. По завершении реакции фенол высвобождается вместе с борной кислотой (H 3 BO 3 ) и бромистоводородной кислотой (водный HBr) при гидролизе производного дибромоборана во время водной обработки.
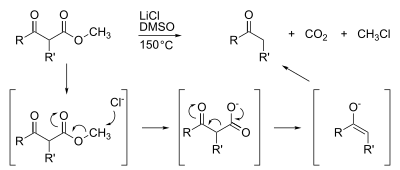
Метиловые эфиры также подвержены деметилированию, которое обычно достигается омылением . Широко распространено высокоспециализированное деметилирование, такое как декарбоксилирование Крапчо :
Смесь анетола, КОН и спирта нагревали в автоклаве. Хотя продукт этой реакции был ожидаемый Anol , высокой реакционной способностью димеризации продукт в маточных растворах называется Dianol также был обнаружен Чарльз Доддс .
N- деметилирование
N- деметилирование 3 ° аминов происходит по реакции фон Брауна , в которой в качестве реагента используется BrCN с образованием соответствующих нор- производных. Был разработан современный вариант реакции Фон Брауна, в котором BrCN был заменен этилхлорформиатом . Получение паксила из ареколина является применением этой реакции, а также, например, для синтеза GSK-372,475 .
Смотрите также
- Метилирование , добавление метильной группы к субстрату