Штрих-кодирование ДНК водорослей - Algae DNA barcoding
| Часть серии о |
| Штрих-кодирование ДНК |
|---|

|
| По таксонам |
| Другой |
ДНК - штрихкодирования из водорослей обычно используется для идентификации видов и филогенетических исследований. Водоросли образуют филогенетически неоднородную группу, а это означает, что применение единого универсального штрих-кода / маркера для разграничения видов невозможно, поэтому для этой цели в разных группах водорослей применяются разные маркеры / штрих-коды .
Диатомеи
Штрих- кодирование диатомовой ДНК - это метод таксономической идентификации диатомовых водорослей даже на уровне видов . Он проводится с использованием ДНК или РНК с последующей амплификацией и секвенированием конкретных консервативных областей в геноме диатомовых водорослей с последующим таксономическим назначением.
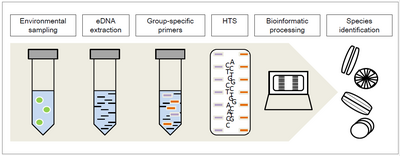
Одна из основных проблем идентификации диатомовых водорослей заключается в том, что они часто собираются как смесь диатомовых водорослей нескольких видов. Метабаркодирование ДНК - это процесс идентификации отдельных видов из смешанного образца ДНК окружающей среды (также называемого эДНК), который представляет собой ДНК, извлеченную прямо из окружающей среды, например, из образцов почвы или воды.
Недавно применяемый метод - это метабаркодирование диатомовой ДНК, которое используется для оценки экологического качества рек и ручьев из-за специфической реакции диатомовых водорослей на определенные экологические условия. Поскольку идентификация видов через морфологию относительно сложна и требует много времени и опыта, высокопроизводительное секвенирование (HTS) ДНК-метабаркодирование позволяет таксономическое отнесение и, следовательно, идентификацию всего образца в отношении групповых праймеров, выбранных для предыдущей амплификации ДНК .
К настоящему времени уже разработано несколько ДНК- маркеров , в основном нацеленных на 18S рРНК . При использовании гипервариабельной области V4 малой субъединицы рибосомы (SSU рДНК) идентификация на основе ДНК оказалась более эффективной, чем подход, основанный на классической морфологии. Другими консервативными участками геномов, которые часто используются в качестве маркерных генов, являются рибулозо-1-5-бисфосфаткарбоксилаза (rbcL), цитохромоксидаза I (cox1, COI), ITS и 28S . Неоднократно было показано, что молекулярные данные, полученные с помощью метабаркодирования диатомовой электронной ДНК, достаточно точно отражают основанные на морфологии биотические индексы диатомей и, следовательно, обеспечивают аналогичную оценку состояния экосистемы. Тем временем диатомовые водоросли обычно используются для оценки экологического качества других пресноводных экосистем. Вместе с водными беспозвоночными они считаются лучшими индикаторами нарушений, связанных с физическим, химическим или биологическим состоянием водотоков. В многочисленных исследованиях бентические диатомеи используются для биомониторинга. Поскольку не было найдено идеального штрих-кода ДНК диатомовых водорослей, было предложено использовать разные маркеры для разных целей. Действительно, сильно вариабельные гены cox1, ITS и 28S были сочтены более подходящими для таксономических исследований, в то время как более консервативные гены 18S и rbcL кажутся более подходящими для биомониторинга.
Преимущества
Применение концепции штрих-кодирования ДНК к диатомовым водорослям обещает большой потенциал для решения проблемы неточной идентификации видов и, таким образом, облегчения анализа биоразнообразия образцов окружающей среды.
Молекулярные методы, основанные на технологии NGS, почти всегда приводят к большему количеству идентифицированных таксонов, присутствие которых впоследствии может быть подтверждено с помощью световой микроскопии. Результаты этого исследования свидетельствуют о том, что штрих-кодирование диатомовых водорослей эДНК подходит для оценки качества воды и может дополнять или улучшать традиционные методы. Stoeck et al. также показали, что штрих-кодирование eDNA дает больше информации о разнообразии диатомовых водорослей или других сообществах протистов и, следовательно, может быть использовано для экологической проекции глобального разнообразия. Другие исследования показали другие результаты. Например, инвентаризационные данные, полученные с помощью молекулярного метода, были ближе к инвентарным данным, полученным с помощью метода, основанного на морфологии, когда в центре внимания находятся многочисленные виды.
Метабаркодирование ДНК может также повысить таксономическое разрешение и сопоставимость по географическим регионам, что часто затруднительно с использованием только морфологических признаков. Более того, идентификация на основе ДНК позволяет расширить круг потенциальных биоиндикаторов, включая незаметные таксономические группы, которые могут быть высокочувствительными или толерантными к определенным стрессорам. Косвенно, молекулярные методы также могут помочь заполнить пробелы в знаниях об экологии видов за счет увеличения количества обрабатываемых образцов в сочетании с сокращением времени обработки (рентабельность), а также за счет повышения точности и точности корреляции между видами. / Возникновение MOTU и факторы окружающей среды.
Вызовы
В настоящее время нет консенсуса относительно методов сохранения и выделения ДНК, выбора штрих-кодов ДНК и праймеров для ПЦР, а также согласия относительно параметров кластеризации MOTU и их таксономического назначения. Отбор проб и молекулярные этапы необходимо стандартизировать с помощью исследований в области развития. Одним из основных ограничений является наличие эталонных штрих-кодов для видов диатомовых водорослей. Справочная база данных таксонов биоиндикаторов далека от завершения, несмотря на постоянные усилия, предпринимаемые в рамках многочисленных национальных инициатив по штрих-кодированию, многие виды по-прежнему не имеют информации о штрих-кодах. Более того, большинство существующих данных по метабаркодированию доступны только локально и географически разбросаны, что препятствует разработке глобально полезных инструментов. Visco et al. По оценкам, в настоящее время в справочных базах данных представлено не более 30% европейских видов диатомовых водорослей. Например, существует значительный недостаток ряда видов из фенноскандинавских сообществ (особенно ацидофильных диатомовых водорослей, таких как Eunotia incisa ). Также было показано, что таксономическая идентификация со штрих-кодированием ДНК не является точной выше уровня видов, например, для различения разновидностей (ссылка отсутствует).
Еще одним хорошо известным ограничением штрихового кодирования для таксономической идентификации является метод кластеризации, используемый до таксономического присвоения: он часто приводит к массовой потере генетической информации, и единственный надежный способ оценить влияние различных процессов кластеризации и различных процессов таксономического присвоения - это сравнение список видов, созданный разными трубопроводами при использовании одной и той же справочной базы данных. Это еще предстоит сделать для различных трубопроводов, используемых для молекулярной оценки сообществ диатомовых водорослей в Европе. Таксономически проверенные базы данных, которые включают доступные ваучеры, также имеют решающее значение для надежной идентификации таксонов с помощью NGS.
Кроме того, часто обнаруживается, что смещение праймеров является основным источником вариаций в штрих-кодировании, а эффективность праймеров для ПЦР может различаться для разных видов диатомовых водорослей, т.е. некоторые праймеры приводят к преимущественной амплификации одного таксона по сравнению с другим.
Вывод о численности из данных метабаркодирования считается одним из самых сложных вопросов при использовании в окружающей среде. Количество последовательностей, сгенерированных HTS, не соответствует напрямую количеству образца или биомассы, и что разные виды могут производить разное количество считываний (например, из-за различий в размере хлоропластов с маркером rbcL). Vasselon et al. недавно создали поправочный коэффициент биобъема при использовании маркера rbcL. Например, Achnanthidium minutissimum имеет небольшой биологический объем и, следовательно, будет генерировать меньше копий фрагмента rbcL (расположенного в хлоропласте), чем более крупные виды. Этот поправочный коэффициент, однако, требует обширной калибровки с собственным биомом каждого вида и до сих пор был протестирован только на нескольких видах. Колебания числа копий гена для других маркеров, таких как маркер 18S, не кажутся видоспецифичными, но еще не были протестированы.
Целевые регионы диатомовых водорослей
Маркер штрих-кодирования обычно комбинирует гипервариабельные области генома (чтобы сделать возможным различие между видами) с очень консервативной областью (чтобы обеспечить специфичность по отношению к целевому организму). Несколько ДНК-маркеров, принадлежащих к ядерным, митохондриальным и хлоропластным геномам ( rbcL , COI , ITS + 5.8S , SSU , 18S ...), были разработаны и успешно использованы для идентификации диатомовых водорослей с помощью NGS.
Субблоки 18S и V4
Область гена 18S широко использовалась в качестве маркера в других группах протистов, и Jahn et al. были первыми, кто протестировал область гена 18S для штрих-кодирования диатомовых водорослей. Циммерман и др. предложили фрагмент длиной 390–410 п.н. локуса гена 18S рРНК длиной 1800 п.н. в качестве маркера штрих-кода для анализа образцов окружающей среды с помощью HTS. и обсуждает его использование и ограничения для идентификации диатомовых водорослей. Этот фрагмент включает субъединицу V4, которая является самой большой и сложной из высоко вариабельных областей в локусе 18S. Они подчеркнули, что эта гипервариабельная область гена 18S имеет большой потенциал для изучения разнообразия простейших в крупном масштабе, но имеет ограниченную эффективность для идентификации ниже уровня видов или скрытых видов.
rbcL
Ген rbcl используется для таксономических исследований (Trobajo et al. 2009), преимущества которого заключаются в том, что редко возникают внутригеномные вариации, и они очень легко выравниваются и сравниваются. Справочная библиотека с открытым доступом под названием R-Syst :: diatom включает данные для двух штрих-кодов (18S и rbcL). Он находится в свободном доступе через веб-сайт. Kermmarec et al. также успешно использовали ген rbcL для экологической оценки диатомовых водорослей. Маркер rbcL также легко выравнивается и сравнивается.
Мониш и Качмарска исследовали успешность амплификации маркеров SSU, COI и ITS2 и обнаружили, что фрагмент ITS-2 + 5.8S размером 300–400 п.н. обеспечивает самый высокий уровень успешности амплификации и хорошее разрешение видов. Этот маркер впоследствии был использован для разделения морфологически определенных видов с успешностью 99,5%. Несмотря на такой успех амплификации, Zimmerman et al. критиковал использование ITS-2 из-за внутриличностной неоднородности. Было высказано предположение, что SSU или rbcL (Mann et al., 2010) являются менее гетерогенными между индивидуумами и, следовательно, более полезными при различении между видами.
Приложения
Генетический инструмент для биомониторинга и биооценки
Диатомовые водоросли обычно используются как часть набора инструментов биомониторинга, мониторинг которых должен осуществляться в рамках Европейской рамочной директивы по водным ресурсам. Диатомовые водоросли используются в качестве индикатора здоровья экосистемы пресноводных водоемов, поскольку они повсеместно распространены, напрямую зависят от изменений физико-химических параметров и демонстрируют лучшую связь с переменными окружающей средой, чем другие таксоны, например, беспозвоночные, что дает лучшую общую картину качества воды.

водных экосистем
За последние годы исследователи разработали и стандартизировали инструменты для метабаркодирования и секвенирования диатомовых водорослей, чтобы дополнить традиционную оценку с использованием микроскопии, открыв новый путь биомониторинга для водных систем. Использование бентических диатомовых водорослей с помощью метода секвенирования нового поколения в речном биомониторинге выявило в нем хороший потенциал. Многие исследования показали, что метабаркодирование и HTS (высокопроизводительное секвенирование) можно использовать для оценки состояния качества и разнообразия пресных вод. В рамках Агентства по окружающей среде Kelly et al. разработала метод метабаркодирования на основе ДНК для оценки сообществ диатомовых водорослей в реках Великобритании. Vasselon et al. сравнили морфологический и HTS подходы для диатомовых водорослей и обнаружили, что HTS дает надежное указание на статус качества для большинства рек с точки зрения индекса специфической загрязненности (SPI). Vasselon et al. также применил метабаркодирование ДНК сообществ диатомовых водорослей к сети мониторинга рек тропического острова Майотта (французский DOM-TOM).
Rimet et al. также исследовали возможность использования HTS для оценки разнообразия диатомовых водорослей и показали, что индексы разнообразия, полученные как с помощью HTS, так и микроскопического анализа, хорошо коррелированы, хотя и не идеальны.
Штрих-кодирование ДНК и метабаркодирование могут использоваться для установления молекулярных показателей и индексов, которые потенциально позволяют сделать выводы, в целом аналогичные выводам традиционных подходов об экологическом и экологическом состоянии водных экосистем.
Криминалистика
В судебно-медицинской практике диатомовые водоросли используются в качестве инструмента диагностики утопления. Тест на диатомовые водоросли основан на принципе вдыхания диатомовых водорослей из воды в легкие и распределения и осаждения по всему телу. Можно использовать методы ДНК, чтобы подтвердить, действительно ли причиной смерти было утопление, и определить источник утопления. Метабаркодирование диатомовой ДНК дает возможность быстро проанализировать сообщество диатомовых водорослей, присутствующее в теле, определить причину утопления и выяснить, могло ли тело быть перемещено из одного места в другое.
Загадочные виды и базы данных
Метабаркодирование диатомовых водорослей может помочь определить границы загадочных видов, которые трудно идентифицировать с помощью микроскопии, и поможет заполнить справочные базы данных путем сравнения морфологических комплексов с данными метабаркодирования.
Другие микроводоросли
Хлорофиты обладают древней и очень разнообразной таксономической родословной (Fang et al. 2014), включая и наземные растения. Несмотря на то, что более 14 000 видов были описаны на основе структурных и ультраструктурных критериев (Hall et al. 2010), их морфологическая идентификация часто ограничена.
Было предложено несколько штрих-кодов для хлорофитов для идентификации на основе ДНК, чтобы обойти морфологическую проблематику. Хотя кодирующий ген цитохромоксидазы I (COI, COX) (ссылка) является стандартным штрих-кодом для животных, он оказался неудовлетворительным для хлорофитов, поскольку ген содержит несколько интронов в этой группе водорослей (Turmel et al. 2002). Ядерные маркерные гены были использованы для хлорофитов: рДНК SSU, рДНК LSU, рДНК ITS (Leliaert et al. 2014).
Макроводоросли
Макроводоросли - морфологическую, а не таксономическую группу - может быть очень сложно идентифицировать из-за их простой морфологии, фенотипической пластичности и альтернативных стадий жизненного цикла. Таким образом, систематика и идентификация водорослей стали во многом полагаться на генетические / молекулярные инструменты, такие как штрих-кодирование ДНК . Ген рДНК SSU - это часто используемый штрих-код для филогенетических исследований макроводорослей. Однако рДНК SSU является высококонсервативной областью и обычно не имеет разрешения для видовой идентификации.
За последние два десятилетия для каждой из основных групп макроводорослей были разработаны определенные стандарты штрих-кодирования ДНК с целью определения видов. Ген субъединицы I цитохром-с-оксидазы (COI) обычно используется в качестве штрих-кода для красных и бурых водорослей, в то время как tufA (фактор удлинения пластид), rbcL (большая субъединица rubisco) и ITS ( внутренний транскрибирующий спейсер ) обычно используются для зеленых водорослей. Эти штрих-коды обычно имеют длину 600-700 бит.
Штрих-коды обычно различаются между 3 основными группами макроводорослей (красные, зеленые и коричневые), потому что их эволюционное наследие очень разнообразно. Макроводоросли - это полифилетическая группа, а это означает, что не все они имеют общего недавнего общего предка, что затрудняет поиск гена, который является консервативным среди всех, но достаточно изменчивым для идентификации видов.
Целевые регионы
| Таксономическая группа | Маркерный ген | ||
| ядерный | митохондриальный | хлоропластид | |
| Хлорофиты | SSU рДНК, LSU рДНК, рДНК ITS | туф A, rbc L | |
| Родофиты | Фикоэритрин, фактор удлинения, рДНК LSU | cox 1, cox 2-3 распорка | rbc L, разделитель Rubisco |
| Феофиты | РДНА ЕГО | cox 1, cox 3 | psb A, rbc L, распорка Rubisco |
| Хризофиты и синурофиты | SSU рДНК, рДНК ЕГО | Кокс 1 | psa A, rbc L |
| Криптофиты | SSU рДНК, LSU рДНК, рДНК ITS | Кокс 1 | Распорка Rubisco |
| Бациллариофиты | SSU рДНК, LSU рДНК, рДНК ITS | Кокс 1 | rbc L |
| Динофиты | LSU рДНК, рДНК ЕГО | cox 1, cob | PsbA NCR , 23S рДНК |
| Гаптофиты | SSU рДНК, LSU рДНК, рДНК, рДНК ЕГО | сох 1b- АТП 4 | tuf A |
| Рафидофиты | SSU рДНК, LSU рДНК, рДНК, рДНК ЕГО | Кокс 1 | psa A , rbc L |
| Ксантофиты | РДНА ЕГО | Rbc L, psb A- rbc L распорка | |
| Хлорарахниофиты | Ядерная рДНК ITS, нуклеоморфная рДНК ITS | ||
| Эвгленофиты | РДНК SSU, рДНК LSU | РДНК SSU, рДНК LSU | |
Адаптировано из
Смотрите также
Подробную информацию о штрих-кодировании ДНК различных организмов можно найти здесь:
Штрих-кодирование микробной ДНК
Штрих-кодирование ДНК при оценке диеты