Вращательно-колебательная спектроскопия - Rotational–vibrational spectroscopy
| Связь в науке |
|---|
| Классическая муфта |
| Квантовая связь |
Вращательная-колебательная спектроскопия является филиалом молекулярной спектроскопии , связанной с инфракрасными и спектрами комбинационного рассеяния из молекул в газовой фазе . Переходы, включающие изменения как колебательного, так и вращательного состояний, могут быть сокращены как вращательные (или вращательно -колебательные ) переходы. Когда такие переходы испускают или поглощают фотоны ( электромагнитное излучение ), частота пропорциональна разнице уровней энергии и может быть обнаружена с помощью определенных видов спектроскопии . Поскольку изменения уровней вращательной энергии обычно намного меньше, чем изменения уровней колебательной энергии, считается, что изменения во вращательном состоянии придают тонкую структуру колебательному спектру. Для данного колебательного перехода такая же теоретическая трактовка, как и для чистой вращательной спектроскопии, дает вращательные квантовые числа , уровни энергии и правила отбора . В молекулах с линейной и сферической вершиной линии вращения обнаруживаются как простые прогрессии как на более высоких, так и на более низких частотах относительно частоты чистой вибрации. В молекулах с симметричным верхом переходы классифицируются как параллельные, когда изменение дипольного момента параллельно главной оси вращения, и перпендикулярные, когда изменение перпендикулярно этой оси. Ро-колебательный спектр асимметричного ротора воды имеет важное значение из-за наличия водяного пара в атмосфере.
Обзор
Ro-колебательная спектроскопия касается молекул в газовой фазе . Есть последовательности квантованных вращательных уровней, связанных как с основным, так и с возбужденным колебательными состояниями. Спектры часто разделяются на линии из-за переходов с одного вращательного уровня в основном колебательном состоянии на один вращательный уровень в колебательно-возбужденном состоянии. Линии, соответствующие данному колебательному переходу, образуют полосу .
В простейших случаях часть инфракрасного спектра, содержащая колебательные переходы с одинаковым вращательным квантовым числом (ΔJ = 0) в основном и возбужденном состояниях, называется Q-ветвью. На высокочастотной стороне Q-ветви энергия вращательных переходов добавляется к энергии колебательного перехода. Это известно как R-ветвь спектра при ΔJ = +1. P-ветвь при ΔJ = −1 лежит на стороне с низким волновым числом Q-ветви. Внешний вид R-ветви очень похож на внешний вид спектра чистого вращения, а P-ветвь выглядит почти зеркальным отображением R-ветви.
Возникновение вращательной тонкой структуры определяется симметрией молекулярных роторов, которые классифицируются так же, как и для чистой вращательной спектроскопии, на линейные молекулы, сферические, симметричные и асимметричные роторы. Квантово-механическая трактовка вращательной тонкой структуры такая же, как и для чистого вращения .
Общее соглашение заключается в том, чтобы обозначать величины, которые относятся к колебательному основному и возбужденному состояниям перехода, двойным штрихом и одинарным штрихом соответственно. Например, постоянная вращения для основного состояния записывается как, а для возбужденного состояния - как. Кроме того, эти константы выражаются в единицах измерения молекулярного спектроскопа в см -1 . так что в этой статье соответствует определению постоянной вращения жесткого ротора .
Метод сочетания отличий
Численный анализ вращательно-колебательных спектральных данных может быть затруднен тем фактом, что волновое число для каждого перехода зависит от двух вращательных постоянных и . Однако комбинации, которые зависят только от одной постоянной вращения, находятся путем вычитания волновых чисел пар линий (одна в P-ветви и одна в R-ветви), которые имеют один и тот же нижний уровень или один и тот же верхний уровень. Например, в двухатомной молекуле линия, обозначенная P ( J + 1), обусловлена переходом ( v = 0, J + 1) → ( v = 1, J ), а линия R ( J - 1) связана с переходу ( v = 0, J - 1) → ( v = 1, J ). Разница между двумя волновыми числами соответствует разнице энергий между уровнями ( J + 1) и ( J - 1) нижнего колебательного состояния и обозначается как, поскольку это разница между уровнями, различающимися на две единицы J. Если центробежное искажение включен, это дается
Вращательная постоянная основного колебательного состояния B '' и центробежной константы искажения, D '' может быть найдено методом наименьших квадратов , установленных эту разницу как функцию J . Константа B ′ ′ используется для определения межъядерного расстояния в основном состоянии, как и в чистой вращательной спектроскопии . (См. Приложение )
Точно так же разность R ( J ) - P ( J ) зависит только от констант B 'и D ' для возбужденного колебательного состояния ( v = 1), и B 'может использоваться для определения межъядерного расстояния в этом состоянии (которое равно недоступные для чистой вращательной спектроскопии).
Линейные молекулы
Гетероядерные двухатомные молекулы

Двухатомные молекулы с общей формулой AB имеют одну нормальную моду колебаний, включающую растяжение связи AB. Значения колебательного члена для ангармонического осциллятора в первом приближении задаются выражением
где v - колебательное квантовое число , ω e - гармоническое волновое число, а χ e - константа ангармонизма.
Когда молекула находится в газовой фазе, она может вращаться вокруг оси, перпендикулярной оси молекулы, проходящей через центр масс молекулы. Вращательная энергия также квантуется со значениями членов в первом приближении, задаваемыми формулой
где J - вращательное квантовое число, а D - константа центробежного искажения . Постоянная вращения B v зависит от момента инерции молекулы I v , который изменяется в зависимости от колебательного квантового числа v.
где m A и m B - массы атомов A и B, а d - расстояние между атомами. Значения членов вращательно-колебательных состояний находятся (в приближении Борна – Оппенгеймера ) путем комбинирования выражений для вибрации и вращения.
Первые два члена в этом выражении соответствуют гармоническому осциллятору и жесткому ротору, вторая пара членов вносит поправку на ангармонизм и центробежные искажения. Более общее выражение было дано Данхэмом .
Правило отбора для электрического диполя разрешено ро-колебательные переходы, в случае диамагнитной двухатомной молекулы
Переход с Δv = ± 1 известен как основной переход. Правило выбора имеет два следствия.
- И колебательные, и вращательные квантовые числа должны измениться. Переход: (Q-ветвь) запрещен
- Изменение энергии вращения может быть либо вычтено, либо добавлено к изменению энергии вибрации, давая P- и R-ветви спектра, соответственно.
Расчет волновых чисел перехода сложнее, чем для чистого вращения, поскольку постоянная вращения B ν различна в основном и возбужденном колебательных состояниях. Упрощенное выражение для волновых чисел получается, когда константы центробежных искажений и примерно равны друг другу.

где положительные значения m относятся к R-ветви, а отрицательные значения относятся к P-ветви. Член ω 0 указывает положение (отсутствующей) Q-ветви, термин подразумевает последовательность равноотстоящих линий в P- и R-ветвях, но третий член показывает, что расстояние между соседними линиями изменяется с изменением угла поворота. квантовое число. Когда больше чем , как это обычно бывает, с увеличением J расстояние между линиями уменьшается в R-ветви и увеличивается в P-ветви. Анализ данных инфракрасного спектра окиси углерода дает значения 1,915 см -1 и 1,898 см -1 . Длины связей легко получить из этих констант: r 0 = 113,3 пм, r 1 = 113,6 пм. Эти длины связи немного отличаются от длины равновесной связи. Это связано с тем, что в основном колебательном состоянии присутствует энергия нулевой точки , тогда как длина равновесной связи минимальна на кривой потенциальной энергии. Связь между постоянными вращения определяется выражением
где ν - колебательное квантовое число, а α - константа взаимодействия колебания и вращения, которую можно вычислить, когда могут быть найдены значения B для двух различных колебательных состояний. Для окиси углерода r экв = 113,0 пм.
Оксид азота , NO, представляет собой особый случай, поскольку молекула парамагнитна с одним неспаренным электроном. Связь спинового углового момента электрона с колебанием молекулы вызывает лямбда-удвоение с расчетными частотами гармоник 1904,03 и 1903,68 см -1 . Уровни вращения также разделены.
Гомоядерные двухатомные молекулы
Квантовая механика для гомоядерных двухатомных молекул, таких как диазот , N 2 и фтор , F 2 , качественно такая же, как для гетероядерных двухатомных молекул, но правила отбора, регулирующие переходы, другие. Поскольку электрический дипольный момент гомоядерной диатомии равен нулю, фундаментальный колебательный переход запрещен по электрическому диполю и молекулы неактивны в инфракрасном диапазоне. Однако слабый квадрупольно-разрешенный спектр N 2 может наблюдаться при использовании больших расстояний как в лаборатории, так и в атмосфере. Спектры этих молекул можно наблюдать с помощью спектроскопии комбинационного рассеяния, поскольку молекулярное колебание разрешено рамановским методом.
Кислород - это особый случай, поскольку молекула парамагнитна, поэтому магнитно-дипольные переходы можно наблюдать в инфракрасном диапазоне. Единичный спин электрона имеет три пространственные ориентации относительно вектора вращательного момента молекулы, N, так что каждый вращательный уровень разбивается на три состояния с полным угловым моментом (вращение молекулы плюс спин электрона) , J = N + 1, N, и N - 1, каждое J-состояние этого так называемого триплета p-типа возникает из-за разной ориентации спина по отношению к вращательному движению молекулы. Правила выбора для магнитных дипольных переходов допускают переходы между последовательными членами триплета (ΔJ = ± 1), так что для каждого значения квантового числа N вращательного момента количества движения существует два разрешенных перехода. 16 Ядро вывода имеет нулевой ядерный спиновый момента, так что соображения симметрии требуют , чтобы N может иметь только нечетные значения.
Рамановские спектры двухатомных молекул
Правило выбора
так что спектр имеет O-ветвь (∆ J = −2), Q-ветвь (∆ J = 0) и S-ветвь (∆ J = + 2). В приближении B ′ ′ = B ′ = B волновые числа имеют вид
так как S-ветвь начинается с J = 0, а O-ветвь - с J = 2. Таким образом, в первом приближении, разделение между S (0) и O (2) составляет 12 В , а расстояние между соседними линиями в обоих О- и S - ветвей 4 Б . Наиболее очевидный эффект того факта, что B ′ ′ ≠ B ′ состоит в том, что Q-ветвь имеет ряд близко расположенных боковых линий на низкочастотной стороне из-за переходов, в которых Δ J = 0 для J = 1,2 и т. Д. • Полезные формулы разности без учета центробежных искажений заключаются в следующем.
Молекулярный кислород - это особый случай, поскольку молекула парамагнитна с двумя неспаренными электронами.
В гомоядерной диатомике статистические веса ядерных спинов приводят к чередованию интенсивностей линий между четными и нечетными уровнями. Для ядерного спина I = 1/2, как в 1 H 2 и 19 F 2, чередование интенсивности составляет 1: 3. Для 2 H 2 и 14 N 2 , I = 1 и статистические веса являются 6 и 3 , так что четно уровни в два раза интенсивнее. Для 16 O 2 ( I = 0) запрещены все переходы с четными значениями .
Многоатомные линейные молекулы

Спектр изгибной моды в 14 N 14 N 16 O смоделирован с помощью Spectralcalc. Слабый наложенный спектр обусловлен видами, содержащими 15 N при естественном содержании 0,3%.
|

Спектр перпендикулярной полосы ацетилена C 2 H 2 , смоделированный с помощью Spectralcalc, демонстрирует 1,3-чередование интенсивности как в P-, так и в R-ветвях. Также Холлас с. 157.
|

Спектр асимметричной (параллельной) полосы диоксида углерода , 12 C 16 O 2, смоделированный с помощью Spectralcalc. Слабый наложенный спектр обусловлен поглощением первого колебательно-возбужденного уровня (0 1 1 0), который из-за своей низкой энергии заселяется при комнатной температуре.
|
Эти молекулы делятся на два класса в соответствии с симметрией : центросимметричные молекулы с точечной группой D ∞h , такие как диоксид углерода , CO 2 , и этин или ацетилен, HCCH; и нецентросимметричные молекулы с точечной группой C ∞v, такие как цианистый водород , HCN и закись азота , NNO. Центросимметричные линейные молекулы имеют дипольный момент, равный нулю, поэтому не показывают чистый спектр вращения в инфракрасной или микроволновой областях. С другой стороны, в определенных колебательно-возбужденных состояниях молекулы действительно обладают дипольным моментом, так что вращательно-колебательный спектр можно наблюдать в инфракрасном диапазоне.
Спектры этих молекул классифицируются по направлению вектора изменения дипольного момента. Когда вибрация вызывает изменение дипольного момента, направленного вдоль оси молекулы, применяется термин « параллель» с символом . Когда вибрация вызывает дипольный момент, указывающий перпендикулярно оси молекулы, применяется термин « перпендикуляр» с символом . В обоих случаях волновые числа P- и R-ветвей следуют той же тенденции, что и в двухатомных молекулах. Эти два класса различаются правилами выбора, которые применяются к колебательным переходам. Для параллельных переходов правило отбора такое же, как и для двухатомных молекул, а именно, переход, соответствующий Q-ветви, запрещен. Примером является CH-валентная мода цианистого водорода.
Для перпендикулярной вибрации допускается переход Δ J = 0. Это означает, что переход разрешен для молекулы с одним и тем же вращательным квантовым числом в основном и возбужденном колебательном состояниях для всех населенных вращательных состояний. Это создает интенсивную, относительно широкую Q-ветвь, состоящую из перекрывающихся линий из-за каждого состояния вращения. Режим изгиба NNO закиси азота , при прибл. 590 см -1 является примером.
Спектры центросимметричных молекул демонстрируют чередующиеся интенсивности линий из-за эффектов симметрии квантового состояния, поскольку поворот молекулы на 180 ° вокруг оси двукратного вращения эквивалентен обмену идентичными ядрами. В диоксиде углерода атомы кислорода преобладающих изотопных разновидностей 12 C 16 O 2 имеют нулевой спин и являются бозонами , так что полная волновая функция должна быть симметричной при обмене двух ядер 16 O. Фактор ядерного спина всегда симметричен для двух ядер с нулевым спином, так что фактор вращения также должен быть симметричным, что верно только для четных J-уровней. Вращательные уровни с нечетным J не могут существовать, а разрешенные колебательные полосы состоят только из линий поглощения от начальных уровней с четным J. Разделение между соседними линиями в P- и R-ветвях близко к 4B, а не к 2B, поскольку альтернативные линии отсутствуют. Для ацетилена атомы водорода 1 H 12 C 12 C 1 H имеют спин 1/2 и являются фермионами , поэтому полная волновая функция антисимметрична, когда происходит обмен двумя ядрами 1 H. Как и для орто- и параводорода, функция ядерного спина двух атомов водорода имеет три симметричных орто-состояния и одно антисимметричное пара-состояние. Для трех орто-состояний вращательная волновая функция должна быть антисимметричной, соответствующей нечетному J, а для одного пара-состояния она должна быть симметричной, соответствующей четному J. Таким образом, населенность нечетных J-уровней в три раза выше, чем четных J-уровней, и чередующиеся интенсивности линий находятся в соотношении 3: 1.
Сферические верхние молекулы
Эти молекулы имеют равные моменты инерции относительно любой оси и принадлежат точечным группам T d (тетраэдрический AX 4 ) и O h (октаэдрический AX 6 ). Молекулы с такой симметрией имеют нулевой дипольный момент, поэтому у них нет чистого спектра вращения в инфракрасной или микроволновой областях.
Тетраэдрические молекулы, такие как метан , CH 4 , имеют инфракрасно-активные валентные и изгибные колебания, принадлежащие к представлению T 2 (иногда обозначаемому как F 2 ). Эти колебания трехкратно вырождены, а уровни вращательной энергии имеют три компонента, разделенных взаимодействием Кориолиса . Значения вращательного члена даны в первом приближении следующим образом:
где - константа связи Кориолиса. Правило выбора основной вибрации:
Таким образом, спектр очень похож на спектр перпендикулярного колебания линейной молекулы с сильной Q-ветвью, состоящей из множества переходов, в которых вращательное квантовое число одинаково в основном колебательном и возбужденном состояниях . Эффект Кориолиса связь четко видна в растягивающем колебании CH метана, хотя подробное исследование показало, что формула первого порядка для взаимодействия Кориолиса, приведенная выше, не подходит для метана.
Симметричные верхние молекулы
Эти молекулы имеют уникальную главную ось вращения порядка 3 или выше. Есть два различных момента инерции и, следовательно, две постоянные вращения. Для вращения вокруг любой оси, перпендикулярной единственной оси, момент инерции, а постоянная вращения равна , как для линейных молекул. Однако для вращения вокруг единственной оси момент инерции равен, а постоянная вращения равна . Примеры включают аммиак , NH 3 и метилхлорид , CH 3 Cl (оба молекулярной симметрии описываются точечной группой C 3v ), трифторид бора , BF 3 и пентахлорид фосфора , PCl 5 (оба из точечной группы D 3h ) и бензол , C 6 H 6 (точечная группа D 6h ).
Для симметричных роторов квантовое число J связано с полным угловым моментом молекулы. При заданном значении J, есть 2 J + 1 кратное вырождение с квантовым числом, M принимает значения + J ... 0 ... - J . Третье квантовое число K связано с вращением вокруг главной оси вращения молекулы. Как и в случае линейных молекул, переходы классифицируются как параллельно , или перпендикулярно , в данном случае в соответствии с направлением изменения дипольного момента по отношению к оси вращения главного. Третья категория включает определенные обертоны и комбинированные полосы, которые обладают свойствами как параллельных, так и перпендикулярных переходов. Правила отбора
-
Если K ≠ 0, то Δ J = 0, ± 1 и Δ K = 0
- Если K = 0, то Δ J = ± 1 и Δ K = 0
- Δ J = 0, ± 1 и Δ K = ± 1
Тот факт, что правила отбора различны, является обоснованием для классификации и означает, что спектры имеют другой вид, который часто можно сразу распознать. Выражение для рассчитанных волновых чисел P- и R-ветвей можно представить в виде
в котором m = J +1 для R-ветви и - J для P-ветви. Три константы центробежного искажения , и необходима , чтобы соответствовать термину значения каждого уровня. Волновые числа субструктуры, соответствующей каждой полосе, задаются выражением
представляет собой Q-ветвь подструктуры, положение которой задается формулой
- .
Параллельные полосы
Валентное колебание C-Cl метилхлорида , CH 3 Cl, дает параллельную полосу, поскольку изменение дипольного момента совпадает с 3-кратной осью вращения. Линейчатый спектр достаточно четко показывает субструктуру этой полосы; в действительности, для полного разрешения тонкой структуры потребуется спектроскопия очень высокого разрешения. Аллен и Кросс показывают части спектра CH 3 D и дают подробное описание численного анализа экспериментальных данных.
Перпендикулярные полосы
Правило выбора для перпендикулярных полос дает больше переходов, чем для параллельных полос. Полосу можно рассматривать как серию субструктур, каждая из которых имеет ветви P, Q и R. Q-ветви разделены примерно 2 ( A ′ - B ′). Асимметричное изгибное колебание ГХГ хлористого метила является типичным. Он показывает серию интенсивных Q-ветвей со слабой вращательной тонкой структурой. Анализ спектров усложняется тем фактом, что колебания в основном состоянии связаны симметрией как вырожденные колебания, что означает, что связь Кориолиса также влияет на спектр.
Гибридные полосы
Обертоны вырожденной основной вибрации имеют компоненты более чем одного типа симметрии. Так , например, первый обертон вибрации , принадлежащей к представлению Е в молекуле , как аммиак, NH 3 , будет иметь компоненты , принадлежащие A 1 и Е представлений. Переход к компоненту A 1 даст параллельную полосу, а переход к компоненту E даст перпендикулярные полосы; в результате получается гибридная полоса.
Инверсия в аммиаке
Для аммиака, NH 3 , симметричное изгибное колебание наблюдается в виде двух ветвей около 930 см -1 и 965 см -1 . Это так называемое инверсионное удвоение возникает потому, что симметричное изгибающее колебание на самом деле представляет собой движение большой амплитуды, известное как инверсия , при котором атом азота проходит через плоскость трех атомов водорода, подобно переворачиванию зонтика. Кривая потенциальной энергии для такого колебания имеет двойной минимум для двух пирамидальных геометрий, так что уровни колебательной энергии встречаются парами, которые соответствуют комбинациям колебательных состояний в двух минимумах потенциала. Два состояния v = 1 объединяются, чтобы сформировать симметричное состояние (1 + ) при 932,5 см -1 над основным (0 + ) состояние и антисимметричное состояние (1 - ) при 968,3 см -1 .
Основное колебательное состояние (v = 0) также удваивается, хотя разность энергий намного меньше, и переход между двумя уровнями может быть измерен непосредственно в микроволновом диапазоне, примерно на отметке 30 мин. 24 ГГц (0,8 см -1 ). Этот переход имеет историческое значение и использовался в аммиачном MASER , предшественнике LASER .
Асимметричные верхние молекулы
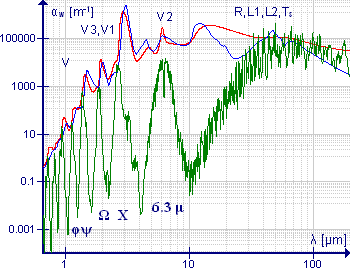
Молекулы с асимметричным верхом имеют не более одной или нескольких осей вращения 2-го порядка. Есть три неравных момента инерции относительно трех взаимно перпендикулярных главных осей . Спектры очень сложные. Волновые числа перехода нельзя выразить аналитической формулой, но можно рассчитать численными методами.
Молекула воды является важным примером этого класса молекул, особенно из-за присутствия водяного пара в атмосфере. Спектр низкого разрешения, показанный зеленым цветом, иллюстрирует сложность спектра. На длинах волн более 10 мкм (или волновых чисел менее 1000 см -1 ) поглощение обусловлено чистым вращением. Полоса около 6,3 мкм (1590 см -1 ) возникает из-за изгибной вибрации HOH; Значительная ширина этой полосы обусловлена наличием обширной вращательной тонкой структуры. Спектры высокого разрешения этой полосы показаны в Allen and Cross, p 221. Симметричные и асимметричные валентные колебания близки друг к другу, поэтому вращательные тонкие структуры этих полос перекрываются. Полосы на более коротких длинах волн представляют собой обертоны и комбинированные полосы, каждая из которых демонстрирует вращательную тонкую структуру. Спектры среднего разрешения полос около 1600 см -1 и 3700 см -1 показаны у Banwell and McCash, p91.
Ro-колебательные полосы молекул асимметричного волчка классифицируются как A-, B- или C-типы для переходов, в которых изменение дипольного момента происходит вдоль оси наименьшего момента инерции к наибольшему.
Экспериментальные методы
Спектры Ro-колебания обычно измеряются с высоким спектральным разрешением . В прошлом это достигалось за счет использования эшелле-решетки в качестве элемента спектральной дисперсии в решетчатом спектрометре . Это тип дифракционной решетки, оптимизированный для использования более высоких порядков дифракции. Сегодня для всех разрешений предпочтительным методом является FTIR . Основная причина этого заключается в том, что инфракрасные детекторы по своей природе зашумлены, а FTIR обнаруживает суммированные сигналы на нескольких длинах волн, одновременно обеспечивая более высокое отношение отношения к шуму благодаря преимуществу Феллгетта для мультиплексированных методов. Разрешающая способность FTIR- спектрометра зависит от максимального замедления движущегося зеркала. Например, для достижения разрешения 0,1 см -1 движущееся зеркало должно иметь максимальное смещение 10 см от своего положения при нулевой разности хода. Конн измерил спектр колебания-вращения венерианского CO 2 с этим разрешением. В настоящее время коммерчески доступен спектрометр с разрешением 0,001 см -1 . Преимущество в пропускной способности FTIR важно для спектроскопии высокого разрешения, поскольку монохроматор в дисперсионном приборе с таким же разрешением имел бы очень узкие входные и выходные щели .
При измерении спектров газов относительно легко получить очень большие расстояния, используя ячейку многократного отражения. Это важно, поскольку позволяет снизить давление, чтобы свести к минимуму расширение спектральных линий давлением , которое может ухудшить разрешение. Длины дорожек до 20 м доступны в продаже.
Заметки
Приложение
Метод комбинационных различий использует различия волновых чисел в P- и R-ветвях для получения данных, которые зависят только от постоянных вращения в основном или возбужденном колебательном состоянии. Для возбужденного состояния
Эта функция может быть адаптирована с использованием метода наименьших квадратов к данным для окиси углерода, полученным Харрисом и Бертолуччи. Данные рассчитываются по формуле
в которых не учитывается центробежное искажение, показаны в столбцах, обозначенных (1). Эта формула подразумевает, что данные должны лежать на прямой с наклоном 2B ′ ′ и пересекать ноль. На первый взгляд кажется, что данные соответствуют этой модели со среднеквадратичной невязкой 0,21 см -1 . Однако с учетом центробежных искажений по формуле
аппроксимация методом наименьших квадратов заметно улучшилась, при этом остаточная мс уменьшилась до 0,000086 см -1 . Расчетные данные показаны в столбцах, обозначенных (2).
| J | 2J + 1 | Рассчитано (1) | Остаточный (1) | Рассчитано (2) | Остаточный (2) | |
|---|---|---|---|---|---|---|
| 1 | 3 | 11,4298 | 11,3877 | 0,0421 | 11,4298 | -0,000040 |
| 2 | 5 | 19,0493 | 18,9795 | 0,0698 | 19,0492 | 0,000055 |
| 3 | 7 | 26,6680 | 26,5713 | 0,0967 | 26,6679 | 0,000083 |
| 4 | 9 | 34,2856 | 34,1631 | 0,1225 | 34,2856 | 0,000037 |
| 5 | 11 | 41,9020 | 41,7549 | 0,1471 | 41,9019 | 0,000111 |
| 6 | 13 | 49,5167 | 49,3467 | 0,1700 | 49,5166 | 0,000097 |
| 7 | 15 | 57,1295 | 56,9385 | 0,1910 | 57,1294 | 0,000089 |
| 8 | 17 | 64,7401 | 64,5303 | 0,2098 | 64,7400 | 0,000081 |
| 9 | 19 | 72,3482 | 72,1221 | 0,2261 | 72,3481 | 0,000064 |
| 10 | 21 год | 79,9536 | 79,7139 | 0,2397 | 79,9535 | 0,000133 |
| 11 | 23 | 87,5558 | 87,3057 | 0,2501 | 87,5557 | 0,000080 |
| 12 | 25 | 95,1547 | 94,8975 | 0,2572 | 95,1546 | 0,000100 |
| 13 | 27 | 102,7498 | 102,4893 | 0,2605 | 102,7498 | -0,000016 |
| 14 | 29 | 110,3411 | 110,0811 | 0,2600 | 110,3411 | 0,000026 |
| 15 | 31 год | 117,9280 | 117,6729 | 0,2551 | 117,9281 | -0,000080 |
| 16 | 33 | 125,5105 | 125,2647 | 0,2458 | 125,5105 | -0,000041 |
| 17 | 35 год | 133,0882 | 132,8565 | 0,2317 | 133,0882 | 0,000035 |
| 18 | 37 | 140,6607 | 140,4483 | 0,2124 | 140,6607 | 0,000043 |
| 19 | 39 | 148,2277 | 148.0401 | 0,1876 | 148,2277 | -0,000026 |
| 20 | 41 год | 155,7890 | 155,6319 | 0,1571 | 155,7891 | -0,000077 |
| 21 год | 43 год | 163,3443 | 163,2237 | 0,1206 | 163,3444 | −0,000117 |
| 22 | 45 | 170,8934 | 170,8155 | 0,0779 | 170,8935 | -0,000053 |
| 23 | 47 | 178,4358 | 178,4073 | 0,0285 | 178,4359 | -0,000093 |
| 24 | 49 | 185,9713 | 185,9991 | -0,0278 | 185,9714 | −0,000142 |
| 25 | 51 | 193,4997 | 193,5909 | -0,0912 | 193,4998 | −0,000107 |
| 26 | 53 | 201.0206 | 201,1827 | −0,1621 | 201.0207 | -0,000097 |
| 27 | 55 | 208,5338 | 208,7745 | -0,2407 | 208,5338 | -0,000016 |
| 28 год | 57 | 216,0389 | 216,3663 | -0,3274 | 216,0389 | 0,000028 |
| 20 | 59 | 223,5357 | 223,9581 | -0,4224 | 223,5356 | 0,000128 |
| 30 | 61 год | 231,0238 | 231,5499 | -0,5261 | 231,0236 | 0,000178 |
Рекомендации
Библиография
- Allen, HC; Крест, PC (1963). Молекулярные виброторы; теория и интерпретация инфракрасных спектров высокого разрешения . Нью-Йорк: Вили.
- Аткинс, П. В.; де Паула, Дж. (2006). Физическая химия (8-е изд.). Издательство Оксфордского университета. стр. 431 -469. ISBN 0198700725 . Номера глав (Молекулярная спектроскопия), Разделов (Спектры колебания-вращения) и номера страниц могут быть разными в разных изданиях.
- Banwell, Colin N .; Маккэш, Элейн М. (1994). Основы молекулярной спектроскопии (4-е изд.). Макгроу-Хилл. п. 40 . ISBN 0-07-707976-0 .
- Холлас, MJ (1996). Современная спектроскопия (3-е изд.). Вайли. ISBN 0471965227 .
- Straughan, BP; Уокер, С. (1976). Спектроскопия . 2 (3-е изд.). Чепмен и Холл. С. 176–204. ISBN 0-470-15032-7 .








![\ Delta _ {2} ^ {{\ prime \ prime}} F (J) = {\ bar \ nu} [R (J-1)] - {\ bar \ nu} [P (J + 1)] = (2B ^ {{\ prime \ prime}} - 3D ^ {{\ prime \ prime}}) \ left (2J + 1 \ right) -D ^ {{\ prime \ prime}} \ left (2J + 1 \ справа) ^ {3}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0c7144f8c4b2e88618125e76a231d74803090165)
![\ Delta _ {2} ^ {{\ prime}} F (J) = {\ bar \ nu} [R (J)] - {\ bar \ nu} [P (J)] = (2B ^ {{\ prime}} - 3D ^ {{\ prime}}) \ left (2J + 1 \ right) -D ^ {{\ prime}} \ left (2J + 1 \ right) ^ {3}](https://wikimedia.org/api/rest_v1/media/math/render/svg/48a9c4fced9bf5a88342d7b529e59f6b3bd8bc57)





![{\ Displaystyle G (v) + F_ {v} (J) = \ left [\ omega _ {e} \ left (v + {1 \ over 2} \ right) + B_ {v} J (J + 1) \ right] - \ left [\ omega _ {e} \ chi _ {e} \ left (v + {1 \ over 2} \ right) ^ {2} + DJ ^ {2} (J + 1) ^ {2} \верно]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f29b6ce6939eaa21021fb6adaa4da9c931b66b29)













![\ Delta _ {4} ^ {{\ prime \ prime}} F (J) = {\ bar \ nu} [S (J-2)] - {\ bar \ nu} [O (J + 2)] = 4B ^ {{\ prime \ prime}} (2J + 1)](https://wikimedia.org/api/rest_v1/media/math/render/svg/97bdc201a98a091e3c261cacc3c829555b0d1a26)
![\ Delta _ {4} ^ {{\ prime}} F (J) = {\ bar \ nu} [S (J)] - {\ bar \ nu} [O (J)] = 4B ^ {{\ prime }} (2J + 1)](https://wikimedia.org/api/rest_v1/media/math/render/svg/c66b8555346364f27f93a21c53b86a1cdb201c4e)
















![+ \ left \ {\ left [(A ^ {\ prime} -B ^ {\ prime}) - (A ^ {{\ prime \ prime}} - B ^ {{\ prime \ prime}}) \ right] - \ left [D _ {{JK}} ^ {\ prime} + D _ {{JK}} ^ {{\ prime \ prime}} \ right] m- \ left [D _ {{JK}} ^ {\ prime} -D _ {{JK}} ^ {{\ prime \ prime}} \ right] m ^ {2} \ right \} K ^ {2} - (D_ {K} ^ {\ prime} -D_ {K} ^ {{\ prime \ prime}}) К ^ {4}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e4546c182830b57eaf498de8ddb8ac167d3c059)




![{\ bar \ nu} _ {{sub}} = {\ bar \ nu} _ {0} + \ left [(A ^ {\ prime} -B ^ {\ prime}) - (A ^ {{\ prime \ prime}} - B ^ {{\ prime \ prime}}) \ right] K ^ {2} - (D_ {K} ^ {\ prime} -D_ {K} ^ {{\ prime \ prime}}) К ^ {4}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b449c465c33cdb5fc19d87918f0b67811c0982c)




![\ Delta _ {2} ^ {{\ prime}} F (J) ^ {{наблюдается}} = {\ bar \ nu} [R (J)] - {\ bar \ nu} [P (J)]](https://wikimedia.org/api/rest_v1/media/math/render/svg/da548317a3d8470f63057a9fc8cf45dce0e74b61)



