Пом1 - Pom1
| Пом1 | |
|---|---|
| Идентификаторы | |
| Организм | |
| Условное обозначение | SPAC2F7.03c |
| Entrez | 2541889 |
Pom1 представляет собой протеинкиназу полярности у делящихся дрожжей Schizosaccharomyces pombe ( S. pombe ), которая локализуется на концах клеток и регулирует деление клеток. По мере удлинения клетки уровень Pom1 в середине снижается, что вызывает митоз.
В Ген pom1 кодирует белок , 1087 аминокислот с белком киназы домена , скорее всего , расположенного на карбоксильном конце. Pom1 регулирует сигнальный путь, который включает Cdk1, и в конечном итоге регулирует митотический вход . Клетки с мутантным pom1 образуют перегородки и зону роста, но обнаруживают множество аномалий, включая смещенные или неправильно ориентированные перегородки, биполярный рост, замененный случайным ростом на одном конце, или неправильное расположение оси роста, ведущее к аномальному ветвлению.
Pom1 играет важную роль в дифференциации старого и нового конца клетки S. pombe . Нормальный рост клеток начинается немедленно на старом конце клетки и задерживается на новом конце. Мутанты pom1 показывают немедленный рост с обоих концов. Поскольку было показано, что Pom1 сильно сконцентрирован на новом конце и почти отсутствует на старом конце, он вместе с другими факторами является частью тормозного сигнала, который предотвращает немедленный рост на новом конце. Сверхэкспрессия Pom1 также может приводить к образованию новых концов роста.
Pom1 является относительно уникальной протеинкиназой, поскольку ее ближайший гомолог у S. pombe идентичен только на 55%. Гомологи у других организмов включают Dyrk у крыс, Dyrk2 и Dyrk3 у людей, Yak1p у S. cerevisiae и Minibrain у Drosophila и человека.
Локализация клетки
Во время интерфазы Pom1 располагается по всей клетке, включая медиальные кортикальные узлы. Локализация Pom1 на полюсах во время деления клеток регулируется Tea1 и Tea2. В отсутствие Tea1 и Tea2 Pom1 сохраняет свою киназную активность, но не локализуется на концах клеток. Микротрубочки также помогают локализовать Pom1 в клетке, поскольку было показано, что делокализация Pom1 является результатом разборки микротрубочек . Структурно как каталитические, так и некаталитические области Pom1 необходимы для локализации конца клетки.
Белки Cdr2, Cdr1, Wee1 , Mid1 и Blt1 также расположены в медиальном узле во время интерфазы и, как полагают, являются частью сигнального пути для входа в митоз. Локализация Cdr2 в середине клетки регулируется экспрессией Pom1 и других сигналов, поскольку мутанты pom1 позволяют Cdr2 диффундировать из локализации медиального узла в одну половину клетки.
Размер ячейки и пространственный градиент
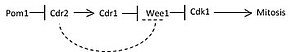
Pom1 образует пространственный градиент по мере удлинения клеток на протяжении фазы G2 . На рис. 1 в виде карикатуры показан градиент Pom1 (показанный темной штриховкой) через сначала относительно небольшую ячейку во время интерфазы, а затем удлиненную ячейку, проходящую через фазу G2 . Когда клетки удлиняются, концентрация Pom1 достигает пика на двух полюсах и уменьшается к центру клетки. Cdr2 считывает убывающий тормозной сигнал от градиента концентрации Pom1 и активирует Cdr1 и Blt1, которые были локализованы в медиальном узле из-за привлечения Cdr2. Cdr1 затем фосфорилирует и ингибирует Wee1 , который также рекрутируется в медиальный узел за счет присутствия Cdr2. Фосфорилированный Wee1 позволяет Cdc25 дефосфорилировать Cdk1 и переводить клетку в митоз . Рис. 2 изображает упрощенный путь передачи сигналов для зависящего от размера входа в митотические клетки, основанный на этой модели. Ингибирование Wee1 непосредственно Cdr2, показанное пунктирной линией, еще не подтверждено.
Испытания модели Pom1
Было показано, что помеченный GFP Pom1 создает градиент в удлиненных клетках, как показано на фиг. 1. Согласно фиг. 2 уменьшение Pom1 в месте расположения Cdr2 в медиальном узле снижает ингибирование Cdr2. В подтверждение взаимодействия этой модели результаты показывают, что клетки с делокализованным Pom1, которые сохраняют полную киназную активность от мутантов tea1, задерживают митотический вход. Вероятно, это связано с продолжающимся ингибированием Cdr2. Дальнейшие эксперименты, которые эктопически локализовали Pom1 по всей коре, также показали отсроченный митотический вход, эквивалентный нокдауну cdr2, что еще раз указывает на то, что Pom1 ингибирует Cdr2, а поскольку Pom1 уменьшается с удлинением клетки, Cdr2 начинает сигнальный путь для ингибирования Wee1 и в конечном итоге входит в митоз .
Будущие исследования
Остается неясным, ингибирует ли Cdr2 Wee1 напрямую или действует только косвенно, через Cdr1 или другие киназы . Более того, Blt1, также локализованный в медиальном узле, может играть роль в регуляции митотического входа. Мутанты Blt1 показывают увеличенную длину, соответствующую отсроченному митотическому входу. Хотя в настоящее время это не подтверждено, предполагается, что Blt1 действует путем ингибирования Wee1 .
Ссылки
- ^ a b c d e f Бахлер Дж. и Прингл Дж. Р. «Pom1p, протеинкиназа делящихся дрожжей, которая обеспечивает информацию о положении как для поляризованного роста, так и для цитокинеза». Genes and Development 12, 1356-1370 (1998).
- ^ a b c d e f g h i j k Moseley, JB, Mayeux, A., Paoletti, A. и Nurse, P. «Пространственный градиент координирует размер клетки и митотический вход в делящихся дрожжах». Nature 459, 857-861 (2009).
- ^ a b c d e Бахлер Дж. и Нерс П. «Активность киназы Pom1p делящихся дрожжей регулируется клеточным циклом и необходима для клеточной симметрии во время роста и деления». EMBO Journal 20, 1064-1073 (2001).
- ^ Соуза, Г.М., Лу, С., и Куспа, А. «YakA, протеинкиназа, необходимая для перехода от роста к развитию у Dictyostelium. Development 125, 2291-2302 (1998).
- ^ Техедор, Ф., Чжу, XR, Кальтенбах, Э., Акерманн, А., Бауман, А., Канал, И., Гейзенберг, М., Фишбах, К. Ф., и Понг, О. «Минибрейн: новый белок.семейство киназ, участвующих в постэмбриональном нейрогенезе у Drosophila. Neuron 14, 287-301 (1995).
- ^ Browning, H., Hayles, J., Mata, J., Aveline, L., Nurse, P. и McIntosh, JR «Tea2p - это кинезиноподобный белок, необходимый для генерации поляризованного роста делящихся дрожжей». Журнал клеточной биологии 151,15-27 (2000).
- ^ a b Беренс Р. и Нерс П. «Роль делящихся дрожжей tea1p в локализации факторов полярности и в организации микротрубочкового цитоскелета». Журнал клеточной биологии 157, 783-793 (2002).
- ^ Моррелл, Дж. Л., Николс, CB, и Гулд, К. Л. «Киназа семейства GIN4, Cdr2p, действует независимо от септинов в делящихся дрожжах. The Journal of Cell Science 117, 5293-5302 (2004).