Трис (этилендиамин) хлорид кобальта (III) - Tris(ethylenediamine)cobalt(III) chloride

|
|||
|
|
|||
| Имена | |||
|---|---|---|---|
|
Название ИЮПАК
трис (этилендиамин) хлорид кобальта
|
|||
| Другие имена
трис (этилендиамин) хлорид кобальта (III)
|
|||
| Идентификаторы | |||
|
3D модель ( JSmol )
|
|||
| ChemSpider | |||
|
PubChem CID
|
|||
|
Панель управления CompTox ( EPA )
|
|||
|
|||
|
|||
| Характеристики | |||
| C 6 H 24 N 6 Cl 3 Co | |||
| Молярная масса | 345,59 | ||
| Появление | желто-оранжевое твердое вещество | ||
| Температура плавления | 275 ° С (527 ° F, 548 К) (разлагается) | ||
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|||
|
|
|||
| Ссылки на инфобоксы | |||
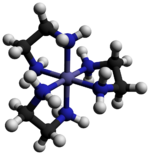
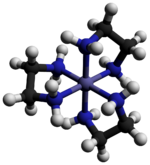
Хлорид трис (этилендиамин) кобальта (III) представляет собой неорганическое соединение с формулой [Co (en) 3 ] Cl 3 (где «en» - это сокращение от этилендиамина ). Это хлоридная соль координационного комплекса [Co (en) 3 ] 3+ . Эта трикация была важна в истории координационной химии из-за ее стабильности и стереохимии . Было описано много различных солей. Комплекс был впервые описан Альфредом Вернером, который выделил эту соль в виде игольчатых кристаллов желто-золотого цвета.
Синтез и структура
Соединение получают из водного раствора этилендиамина и практически любой соли кобальта (II), такой как хлорид кобальта (II) . Раствор продувают воздухом для окисления комплексов кобальт (II) -этилендиамин до кобальта (III). Реакция протекает с выходом 95%, и трикирование может быть выделено с помощью различных анионов. Подробный анализ продукта крупномасштабного синтеза показал, что одним второстепенным побочным продуктом был [Co (en) 2 Cl (H 2 NCH 2 CH 2 NH 3 )] Cl 3 , который содержит редкий монодентатный этилендиаминный лиганд (протонированный).
Катион [Co (en) 3 ] 3+ является октаэдрическим с расстояниями Co-N в диапазоне 1,947–1,981 Å . Углы N-Co-N составляют 85 ° внутри хелатных колец и 90 ° между атомами азота на соседних кольцах.
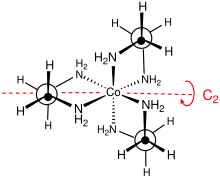
Стереохимия
Точечная группа этого комплекса - D 3 . Комплекс может быть разделен на энантиомеры , которые обозначаются как Δ и Λ. Обычно разрешение связано с использованием виннокислых солей. Оптическое разрешение - стандартная составляющая курсов неорганического синтеза. Из-за непланарности кольца MN 2 C 2 могут принимать любую из двух конформаций , которые описываются символами λ и δ. Регистр между этими кольцевыми конформациями и абсолютной конфигурацией металлических центров описывается номенклатурой lel (когда основная цепь en лежит параллельно оси симметрии C 3 ) или ob (когда основная цепь en находится напротив той же оси C 3 ). . Таким образом, можно выделить следующие диастереомерные конформации: Δ- ( lel ) 3 , Δ- (lel) 2 (ob), Δ- (lel) (ob) 2 и Δ- ( ob ) 3 . Разумеется, существуют и зеркальные изображения этих видов.
Увлажняет
Катионные координационные комплексы аммиака и алкиламинов обычно кристаллизуются с водой в решетке , и стехиометрия может зависеть от условий кристаллизации и, в случае хиральных комплексов, от оптической чистоты катиона. Рацемический [Co (en) 3 ] Cl 3 чаще всего получают в виде ди- или тригидрата. Для оптически чистой соли (+) - [Co (en) 3 ] Cl 3 · 1,5H 2 O, (+) - [Co (en) 3 ] Cl 3 · 0,5NaCl · 3H 2 O и (+) - [Co (en) 3 ] Cl 3 · H 2 O также известны.