Транскриптом - Transcriptome
Транскриптомный это совокупность всех РНК - транскриптов, включая кодирование и некодирующих , в индивидуальной или популяции клеток . Этот термин также может иногда использоваться для обозначения всех РНК или только мРНК , в зависимости от конкретного эксперимента. Термин транскриптом представляет собой набор слов транскрипт и геном ; это связано с процессом производства транскриптов во время биологического процесса транскрипции .
Ранние этапы аннотации транскриптомов начались с публикаций библиотек кДНК в 1980-х годах. Впоследствии появление высокопроизводительной технологии привело к появлению более быстрых и эффективных способов получения данных о транскриптоме. Для изучения транскриптома используются два биологических метода, а именно ДНК-микроматрица , метод на основе гибридизации и RNA-seq , подход, основанный на последовательностях. RNA-seq является предпочтительным методом и доминирующим методом транскриптомики с 2010-х годов. Транскриптомика отдельной клетки позволяет отслеживать изменения транскрипта во времени в отдельных клетках.
Данные, полученные с помощью транскриптома, используются в исследованиях для понимания таких процессов, как клеточная дифференциация , канцерогенез , регуляция транскрипции и открытие биомаркеров . Полученные транскриптомом данные также находят применение в установлении филогенетических отношений в процессе эволюции и при оплодотворении in vitro . Транскриптом тесно связан с другими областями биологических исследований; она является дополнением к протеомом и метаболом и охватывает translatome , ExoME , meiome и thanatotranscriptome , которые можно рассматривать как OME полей изучения типов специфических транскриптов РНК. Существует множество общедоступных баз данных транскриптомов.
Этимология и история
Слово транскриптом представляет собой набор слов транскрипт и геном . Он появился вместе с другими неологизмами, образованными с использованием суффиксов -ome и -omics для обозначения всех исследований, проводимых в масштабе всего генома в областях наук о жизни и технологий. Таким образом, транскриптом и транскриптомика были одними из первых слов, которые появились вместе с геномом и протеомом. Первое исследование, в котором представлен случай коллекции библиотеки кДНК для мРНК шелковой моли, было опубликовано в 1979 году. Первое плодотворное исследование, в котором упоминается и исследуется транскриптом организма, было опубликовано в 1997 году и описало 60 633 транскрипта, экспрессируемых в S. cerevisiae. с использованием серийного анализа экспрессии генов (SAGE). С развитием высокопроизводительных технологий и биоинформатики и последующего увеличения вычислительной мощности стало все более эффективным и простым способом характеризовать и анализировать огромные объемы данных. Попытки охарактеризовать транскриптом стали более заметными с появлением автоматизированного секвенирования ДНК в 1980-х годах. В течение 1990-х годов для идентификации генов и их фрагментов использовалось секвенирование с помощью экспрессируемых меток . За этим последовали такие методы, как последовательный анализ экспрессии генов (SAGE), кэп-анализ экспрессии генов (CAGE) и массовое параллельное секвенирование сигнатур (MPSS).
Транскрипция
Транскриптом включает в себя все транскрипты рибонуклеиновой кислоты (РНК), присутствующие в данном организме или экспериментальном образце. РНК является основным носителем генетической информации, которая отвечает за процесс преобразования ДНК в фенотип организма. Ген может дать начало одноцепочечной информационной РНК (мРНК) посредством молекулярного процесса, известного как транскрипция ; эта мРНК комплементарна цепи ДНК, из которой она произошла. Фермент РНК-полимераза II присоединяется к цепи матричной ДНК и катализирует добавление рибонуклеотидов к 3'-концу растущей последовательности транскрипта мРНК.
Чтобы запустить свою функцию, РНК-полимераза II должна распознавать промоторную последовательность , расположенную выше (5 ') гена. У эукариот этот процесс опосредуется факторами транскрипции , в первую очередь фактором транскрипции II D (TFIID), который распознает ТАТА-бокс и помогает позиционировать РНК-полимеразу в соответствующем стартовом сайте. Для завершения продукции РНК-транскрипта терминация обычно происходит на расстоянии нескольких сотен нуклеотидов от последовательности терминации и происходит расщепление. Этот процесс происходит в ядре клетки вместе с процессингом РНК, с помощью которого молекулы мРНК блокируются , сплайсируются и полиаденилируются для повышения их стабильности перед тем, как впоследствии попасть в цитоплазму. МРНК дает начало белкам в процессе трансляции , происходящей в рибосомах .
Типы транскриптов РНК
В соответствии с центральной догмой молекулярной биологии транскриптом первоначально охватывал только транскрипты мРНК, кодирующие белок. Тем не менее существует несколько подтипов РНК с различными функциями. Многие транскрипты РНК не кодируют белок или выполняют различные регуляторные функции в процессе транскрипции и трансляции генов. Типы РНК, которые не подпадают под рамки центральной догмы молекулярной биологии, - это некодирующие РНК, которые можно разделить на две группы: длинные некодирующие РНК и короткие некодирующие РНК.
Длинная некодирующая РНК включает все транскрипты некодирующей РНК, длина которых превышает 200 нуклеотидов. Члены этой группы составляют самую большую часть некодирующего транскриптома. Короткая некодирующая РНК включает следующих членов:
- Переносная РНК (тРНК)
- микро - РНК (миРНК): 19-24 нуклеотидов (нт) длинные. Микро-РНК повышают или понижают уровни экспрессии мРНК в процессе РНК-интерференции на посттранскрипционном уровне.
- малая интерферирующая РНК (миРНК): 20-24 н.
- малая ядрышковая РНК (мяРНК)
- Piwi-взаимодействующая РНК (пиРНК): 24-31 н. Они взаимодействуют с белками Piwi семейства Argonaute и выполняют функцию нацеливания и расщепления транспозонов .
- энхансерная РНК (эРНК)
Объем исследования
В геноме человека около 5% всех генов транскрибируются в РНК. Транскриптом состоит из кодирующей мРНК, которая составляет около 1-4% от его полноты, и некодирующих РНК, которые составляют остальную часть генома и не образуют белков. Число последовательностей, не кодирующих белок, увеличивается у более сложных организмов.
Несколько факторов затрудняют определение содержания транскриптома. К ним относятся , среди прочего, альтернативный сплайсинг , редактирование РНК и альтернативная транскрипция. Кроме того, методы транскриптома способны фиксировать транскрипцию, происходящую в образце в определенный момент времени, хотя содержание транскриптома может изменяться во время дифференцировки. Основными целями транскриптомики являются следующие: «каталогизация всех видов транскриптов, включая мРНК, некодирующие РНК и малые РНК; определение структуры транскрипции генов с точки зрения их стартовых сайтов, 5 'и 3' концов, сплайсинг паттерны и другие посттранскрипционные модификации, а также для количественной оценки изменяющихся уровней экспрессии каждого транскрипта во время развития и в различных условиях ».
Термин может применяться к общему набору транскриптов в данном организме или к конкретному подмножеству транскриптов, присутствующих в конкретном типе клеток. В отличие от генома , который примерно фиксирован для данной клеточной линии (за исключением мутаций ), транскриптом может изменяться в зависимости от внешних условий окружающей среды. Поскольку он включает в себя все транскрипты мРНК в клетке, транскриптом отражает гены , которые активно экспрессируются в любой момент времени, за исключением явлений деградации мРНК, таких как ослабление транскрипции . Изучение транскриптомики (которое включает профилирование экспрессии , анализ вариантов сплайсинга и т. Д.) Изучает уровень экспрессии РНК в данной популяции клеток, часто сосредотачиваясь на мРНК, но иногда включая другие, такие как тРНК и мРНК.
Способы строительства
Транскриптомика - это количественная наука, которая включает в себя присвоение списка строк («прочтений») объекту («транскриптов» в геноме). Для расчета силы экспрессии подсчитывается плотность считываний, соответствующих каждому объекту. Первоначально транскриптомы анализировали и изучали с использованием библиотек экспрессируемых тегов последовательностей и серийного и кэп-анализа экспрессии генов (SAGE).
В настоящее время к двум основным методам транскриптомики относятся ДНК-микрочипы и RNA-Seq . Оба метода требуют выделения РНК с помощью методов экстракции РНК с последующим ее отделением от других клеточных компонентов и обогащением мРНК.
Существует два основных метода определения последовательностей транскриптомов. Один подход отображает последовательность считывания в эталонном геноме либо самого организма (чей транскриптом изучается), либо близкородственного вида. Другой подход, сборка транскриптомов de novo , использует программное обеспечение для вывода транскриптов непосредственно из считывания коротких последовательностей и используется в организмах с геномами, которые не секвенированы.
ДНК-микрочипы

Первые исследования транскриптома были основаны на методах микроматриц (также известных как ДНК-чипы). Микроматрицы состоят из тонких стеклянных слоев с пятнами, на которых расположены олигонуклеотиды , известные как «зонды»; каждое пятно содержит известную последовательность ДНК.
При выполнении анализа на микрочипах мРНК собирают из контрольного и экспериментального образцов, последний обычно представляет заболевание. Интересующая РНК преобразуется в кДНК для повышения ее стабильности и маркируется флуорофорами двух цветов, обычно зеленого и красного для двух групп. КДНК распределяется по поверхности микрочипа, где она гибридизуется с олигонуклеотидами на чипе, и для сканирования используется лазер. Интенсивность флуоресценции на каждом пятне микроматрицы соответствует уровню экспрессии гена, и на основе цвета выбранных флуорофоров можно определить, какой из образцов демонстрирует более высокие уровни интересующей мРНК.
Один микрочип обычно содержит достаточно олигонуклеотидов, чтобы представить все известные гены; однако данные, полученные с помощью микрочипов, не дают информации о неизвестных генах. В течение 2010-х годов микроматрицы были почти полностью заменены методами следующего поколения, основанными на секвенировании ДНК.
Секвенирование РНК
Секвенирование РНК - это технология секвенирования нового поколения ; как таковой требуется лишь небольшое количество РНК и никаких предварительных знаний о геноме. Он позволяет проводить как качественный, так и количественный анализ транскриптов РНК, первый из которых позволяет обнаруживать новые транскрипты, а второй позволяет измерить относительные количества транскриптов в образце.
Три основных этапа секвенирования транскриптомов любых биологических образцов включают очистку РНК, синтез библиотеки РНК или кДНК и секвенирование библиотеки. Процесс очистки РНК отличается для коротких и длинных РНК. За этим этапом обычно следует оценка качества РНК с целью избежать загрязнения, такого как ДНК, или технических загрязнений, связанных с обработкой образцов. Качество РНК измеряется с помощью УФ-спектрометрии с пиком поглощения 260 нм. Целостность РНК также могут быть проанализированы количественно сравнивать соотношение и интенсивность 28S РНК с 18S РНК сообщили в РНК Целостность Число (RIN) балла. Поскольку мРНК представляет собой интересующий вид и составляет лишь 3% от ее общего содержания, образец РНК следует обработать для удаления рРНК, тРНК и тканеспецифичных транскриптов РНК.
Этап подготовки библиотеки с целью получения коротких фрагментов кДНК начинается с фрагментации РНК до транскриптов длиной от 50 до 300 пар оснований . Фрагментация может быть ферментативной ( эндонуклеазы РНК ), химической (буфер из тризмагниевой соли, химический гидролиз ) или механической ( обработка ультразвуком , распыление). Обратная транскрипция используется для преобразования матриц РНК в кДНК, и для этого можно использовать три метода прайминга, включая олиго-DT, с использованием случайных праймеров или лигирования специальных адаптерных олигонуклеотидов.
Одноклеточная транскриптомика
Транскрипцию также можно изучать на уровне отдельных клеток с помощью транскриптомики отдельной клетки . Секвенирование одноклеточной РНК (scRNA-seq) - это недавно разработанный метод, который позволяет анализировать транскриптом отдельных клеток. При одноклеточной транскриптомике также принимаются во внимание субпопуляции типов клеток, которые составляют интересующую ткань. Этот подход позволяет определить, вызваны ли изменения в экспериментальных образцах фенотипическими клеточными изменениями, а не пролиферацией, при которой определенный тип клеток может быть сверхэкспрессирован в образце. Кроме того, при оценке клеточной прогрессии через дифференцировку средние профили экспрессии могут упорядочивать клетки только по времени, а не по стадии их развития, и, следовательно, не могут показать тенденции в уровнях экспрессии генов, специфичные для определенных стадий. Одноклеточные транскриптомные методы использовались для характеристики популяций редких клеток, таких как циркулирующие опухолевые клетки , раковые стволовые клетки в солидных опухолях и эмбриональные стволовые клетки (ESC) в бластоцистах млекопитающих .
Хотя не существует стандартизированных методов транскриптомики одиночных клеток, необходимо предпринять несколько шагов. Первый шаг включает в себя изоляцию ячеек, которая может быть выполнена с использованием методов с низкой и высокой пропускной способностью. За этим следует стадия кПЦР, а затем одноклеточная RNAseq, на которой интересующая РНК превращается в кДНК. Новые разработки в одноклеточной транскриптомике позволяют сохранять тканевую и субклеточную локализацию посредством криосрезов тонких срезов тканей и секвенирования транскриптома в каждом срезе. Другой метод позволяет визуализировать отдельные транскрипты под микроскопом, сохраняя при этом пространственную информацию каждой отдельной клетки, в которой они экспрессируются.
Анализ
Был создан и аннотирован ряд баз данных транскриптомов для конкретных организмов, чтобы помочь в идентификации генов, которые по-разному экспрессируются в разных популяциях клеток.
RNA-seq появляется (2013) как метод выбора для измерения транскриптомов организмов, хотя все еще используется более старая методика ДНК-микрочипов . RNA-seq измеряет транскрипцию определенного гена путем преобразования длинных РНК в библиотеку фрагментов кДНК . Затем фрагменты кДНК секвенируют с использованием технологии высокопроизводительного секвенирования и выравнивают по эталонному геному или транскриптому, который затем используется для создания профиля экспрессии генов.
Приложения
Млекопитающие
Транскриптомы стволовых и раковых клеток представляют особый интерес для исследователей, которые стремятся понять процессы клеточной дифференциации и канцерогенеза . Трубопровод с помощью РНК-Seq или генных данных массива может быть использован для отслеживания генетических изменений , происходящих в стволовых и предшественников клеток и требует , по меньшей мере три независимых экспрессии генов данных из первого типа клеток и зрелые клетки.
Анализ Транскрипта человеческих ооцитов и эмбрионов используются , чтобы понять молекулярные механизмы и сигнальные пути , контролирующие ранний эмбриональное развитие, и теоретически может быть мощным инструментом в создании правильного выбора эмбриона в экстракорпоральном оплодотворении . Анализ содержания транскриптомов плаценты в первом триместре беременности при экстракорпоральном оплодотворении и переносе эмбриона (IVT-ET) выявил различия в генетической экспрессии, которые связаны с более высокой частотой неблагоприятных перинатальных исходов. Такое понимание можно использовать для оптимизации практики. Анализ транскриптома также может использоваться для оптимизации криоконсервации ооцитов за счет снижения травм, связанных с этим процессом.
Транскриптомика - это развивающаяся и постоянно развивающаяся область открытия биомаркеров для использования при оценке безопасности лекарств или оценке химического риска .
Транскриптомы также могут использоваться для вывода филогенетических отношений между людьми или для обнаружения эволюционных паттернов сохранения транскриптома.
Анализ транскриптомов использовался для выявления случаев антисмысловой транскрипции, их роли в экспрессии генов через взаимодействие с окружающими генами и их распространенности в различных хромосомах. RNA-seq также использовался, чтобы показать, как изоформы РНК, транскрипты, происходящие от одного и того же гена, но с разными структурами, могут производить сложные фенотипы из ограниченных геномов.
Растения
Транскриптомный анализ использовался для изучения процесса эволюции и диверсификации видов растений. В 2014 году был завершен проект « 1000 геномов растений», в ходе которого были секвенированы транскриптомы 1124 видов растений из семейств viridiplantae , glaucophyta и rhodophyta . Последовательности, кодирующие белок, впоследствии сравнивали, чтобы сделать вывод о филогенетических отношениях между растениями и охарактеризовать время их диверсификации в процессе эволюции. Исследования транскриптома использовались для характеристики и количественной оценки экспрессии генов в зрелой пыльце . Было обнаружено, что гены, участвующие в метаболизме клеточной стенки и цитоскелета, сверхэкспрессируются. Транскриптомные подходы также позволяют отслеживать изменения в экспрессии генов на разных стадиях развития пыльцы, от микроспор до зрелых пыльцевых зерен; кроме того, такие стадии можно сравнивать между видами различных растений, включая арабидопсис , рис и табак .
Отношение к другим областям Ome
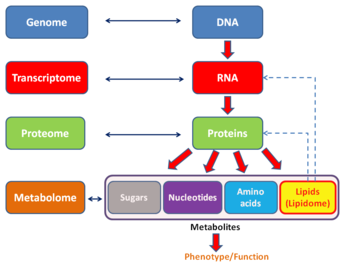
Подобно другая ОМа технологий , основанных, анализ транскриптома позволяет непредвзятый подход при проверке гипотезы экспериментально. Этот подход также позволяет открывать новые медиаторы в сигнальных путях. Как и в случае с другими технологиями на основе -omics, транскриптом может быть проанализирован в рамках мультиомического подхода. Он дополняет метаболомику, но в отличие от протеомики, прямая связь между транскриптом и метаболитом не может быть установлена.
Есть несколько полей -ome, которые можно рассматривать как подкатегории транскриптома. В ExoME отличается от транскриптома тем , что она включает в себя только те молекулы РНК , найденные в указанной популяции клеток, и обычно включает в себя количество или концентрацию каждой молекулы РНК в дополнение к молекулярной идентичности. Кроме того, транскритпом также отличается от трансатома , который представляет собой набор РНК, подвергающихся трансляции.
Термин мейом используется в функциональной геномике для описания мейотического транскриптома или набора транскриптов РНК, образующихся в процессе мейоза . Мейоз - ключевая особенность эукариот , размножающихся половым путем , и включает спаривание гомологичных хромосом , синапсов и рекомбинацию. Поскольку мейоз у большинства организмов происходит за короткий период времени, профилирование мейотических транскриптов затруднено из-за проблемы выделения (или обогащения) мейотических клеток ( мейоцитов ). Как и в случае анализа транскриптомов, мейом можно изучать на уровне всего генома с использованием крупномасштабных транскриптомных методов. Мейом хорошо охарактеризован у млекопитающих и дрожжевых систем и несколько менее широко охарактеризован у растений.
Thanatotranscriptome состоит из всех РНК - транскриптов , которые продолжают быть выражены или что начинают получать повторно экспрессируется во внутренних органах мертвого тела 24-48 часов после смерти. Некоторые гены включают те, которые подавляются после внутриутробного развития . Если танатотранскриптом связан с процессом запрограммированной гибели клеток ( апоптозом ), его можно назвать апоптотическим танатотранскриптомом. Анализы танатотранскриптома используются в судебной медицине .
Картирование eQTL можно использовать для дополнения геномики транскриптомикой; генетические варианты на уровне ДНК, а экспрессия генов измеряется на уровне РНК.
Отношение к протеому
Транскриптом можно рассматривать как подмножество протеома , то есть весь набор белков, экспрессируемых геномом.
Однако анализ относительных уровней экспрессии мРНК может быть затруднен тем фактом, что относительно небольшие изменения в экспрессии мРНК могут вызывать большие изменения общего количества соответствующего белка, присутствующего в клетке. Один из методов анализа, известный как анализ обогащения набора генов , выявляет скорее корегулируемые генные сети, чем отдельные гены, которые регулируются в большей или меньшей степени в разных популяциях клеток.
Хотя исследования с помощью микроматриц могут выявить относительные количества различных мРНК в клетке, уровни мРНК не прямо пропорциональны уровню экспрессии белков, которые они кодируют. Количество белковых молекул, синтезируемых с использованием данной молекулы мРНК в качестве матрицы, сильно зависит от особенностей инициации трансляции последовательности мРНК; в частности, способность последовательности инициации трансляции является ключевым фактором при привлечении рибосом к трансляции белков .
Базы данных транскриптомов
Смотрите также
- Технологии транскриптомики
- Серийный анализ экспрессии генов
- Список тем омиков по биологии
- Метаболом
- Экспрессия гена
- Сетевой анализ взвешенной коэкспрессии генов
- Функциональная геномика
- Translatome
Примечания
использованная литература
- Селлерино, А; Сангуанини, М. (2018), Анализ транскриптома: Введение и примеры из нейробиологии , DOI : 10.1007 / 978-88-7642-642-1 , ISBN 978-88-7642-641-4
дальнейшее чтение
- ^ Субраманьян А, Тамайо Р, Mootha В.К., Мукхержите S, Эберт Б.Л., Жилетт М.А., Павлович А, Помрой SL, ТР Голуб, Ландер Е.С., Mesirov JP. (2005). Анализ обогащения набора генов: основанный на знаниях подход к интерпретации профилей экспрессии в масштабе всего генома. Proc Natl Acad Sci USA102 (43): 15545-50.
- ^ Лаул О, Хирш-Хоффманн М, Хруз Т, Груиссем В и П Циммерманн. (2006) Интернет-анализ транскриптома мыши с помощью Genevestigator. BMC Биоинформатика7: 311
- ^ Assou, S .; Boumela, I .; Haouzi, D .; Анахори, Т .; Dechaud, H .; De Vos, J .; Хамама, С. (2010). «Динамические изменения в экспрессии генов во время раннего развития человеческого эмбриона: от фундаментальных аспектов до клинического применения» . Обновление репродукции человека . 17 (2): 272–290. DOI : 10.1093 / humupd / dmq036 . PMC 3189516 . PMID 20716614 .
- ^ Огородников, А; Каргаполова, Ы; Данквардт, С. (2016). «Процессинг и расширение транскриптома на 3'-конце мРНК в состоянии здоровья и болезни: поиск правильного конца» . Eur J Physiol . 468 (6): 993–1012. DOI : 10.1007 / s00424-016-1828-3 . PMC 4893057 . PMID 27220521 .
