Тефлиевая кислота - Teflic acid
|
|
|||
| Имена | |||
|---|---|---|---|
|
Название ИЮПАК
Пентафторортотеллуровая кислота
|
|||
| Другие имена
Тефлиновая кислота
|
|||
| Идентификаторы | |||
|
3D модель ( JSmol )
|
|||
| ChemSpider | |||
| ECHA InfoCard |
100.161.534 |
||
|
PubChem CID
|
|||
|
Панель управления CompTox ( EPA )
|
|||
|
|||
|
|||
| Характеристики | |||
| HF 5 OTe | |||
| Молярная масса | 239,6 | ||
| Появление | бесцветное твердое вещество | ||
| Температура плавления | 39,1 ° С (102,4 ° F, 312,2 К) | ||
| Точка кипения | 59,7 ° С (139,5 ° F, 332,8 К) | ||
| Опасности | |||
| Основные опасности | коррозионный, токсичный | ||
| Пиктограммы GHS |

|
||
| Сигнальное слово GHS | Опасность | ||
| H314 , H318 | |||
| Р260 , Р264 , Р280 , Р301 + 330 + 331 , P303 + 361 + 353 , Р304 + 340 , P305 + 351 + 338 , P310 , P321 , P363 , P405 , P501 | |||
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|||
|
|
|||
| Ссылки на инфобоксы | |||
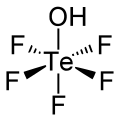
Тефлиевая кислота - это химическое соединение с формулой HOTeF 5 . Эта сильная кислота связана с ортотеллуровой кислотой Те (ОН) 6 . Тефлиевая кислота имеет слегка искаженную октаэдрическую геометрию.
Подготовка
Тефлиевая кислота была случайно открыта Энгельбрехтом и Сладким. Их синтез дал не ожидаемый теллурилфторид TeO 2 F 2 , а смесь летучих теллурических соединений, ia HOTeF 5 :
- BaTeO 4 + 10HOSO 2 F → HOTeF 5 (25%)
Тефлиевая кислота также может быть получена из фторсульфоновой кислоты и теллурата бария:
- 5HOSO 2 F + BaO 2 Te (OH) 4 → HOTeF 5 + 4 H 2 SO 4 + BaSO 4
Это также первый продукт гидролиза гексафторида теллура :
- TeF 6 + H 2 O → HOTeF 5 + HF
Тефлаты
Основание, сопряженное с тефлевой кислотой, называется тефлат-анионом F 5 TeO - (не путать с трифлатом ). Известно много тефлатов, примерами которых являются B (OTeF 5 ) 3 и ангидрид кислоты O (TeF 5 ) 2 . Пиролиз соединения бора дает димер (TeF 4 O) 2
- 2 Б (OTeF 5 ) 3 → 2 В (OTeF 5 ) 2 F + (OTeF 4 ) 2
Известно, что тефлат-анион сопротивляется окислению. Это свойство позволило получить несколько весьма необычных соединений, таких как гексатфлаты M (OTeF 5 ) 6 - (M = As, Sb, Bi). Ксенон образует катион Xe (OTeF 5 ) + .
использованная литература
дальнейшее чтение
- РБ Кинг; Неорганическая химия элементов основной группы , VCH Publishers, Нью-Йорк, 1994.