Реакция Симмонса – Смита - Simmons–Smith reaction
 Продолжается реакция Симмонса-Смита
|
| Симмонс-Смит реакция | |
|---|---|
| Названный в честь |
Говард Энсин Симмонс-младший Рональд Д. Смит |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Портал органической химии | Симмонс-Смит-реакция |
| Идентификатор онтологии RSC | RXNO: 0000258 |
Реакция Симмонса-Смита - это органическая хелетропная реакция с участием цинкорганического карбеноида, который реагирует с алкеном (или алкином ) с образованием циклопропана . Он назван в честь Говарда Энсина Симмонса-младшего и Рональда Д. Смита . Он использует промежуточный продукт свободных радикалов метилен, который доставляется к обоим атомам углерода алкена одновременно, поэтому конфигурация двойной связи сохраняется в продукте, и реакция является стереоспецифической.
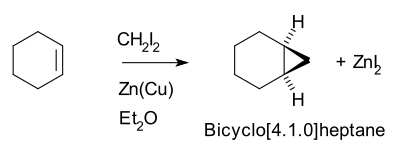
Таким образом, циклогексен , дииодметан и пара цинк-медь (как иодметилцинк иодид , ICH 2 ZnI) дают норкаран (бицикло [4.1.0] гептан).
Реакция Симмонса-Смита обычно предпочтительнее других методов циклопропанирования, однако она может быть дорогостоящей из-за высокой стоимости дииодметана. Были разработаны модификации, включающие более дешевые альтернативы, такие как дибромметан или диазометан и йодид цинка . Реакционную способность системы также можно повысить, используя модификацию Фурукавы, заменяя пару цинк-медь на диэтилцинк .
Реакция Симмонса-Смита обычно подвержена стерическим эффектам , и поэтому циклопропанирование обычно происходит на менее затрудненной поверхности. Однако, когда гидроксизаместитель присутствует в субстрате рядом с двойной связью, цинк координируется с гидроксизаместителем, направляя циклопропанирование цис к гидроксильной группе (что может не соответствовать циклопропанированию стерически наиболее доступной стороны двойной связи. ): Интерактивную 3D-модель этой реакции можно увидеть на ChemTube3D .
Асимметричная реакция Симмонса – Смита.
Хотя асимметричные методы циклопропанирования на основе диазосоединений (см. Бисоксазолиновый лиганд ) существуют с 1966 года, асимметричная реакция Симмонса-Смита была введена в 1992 году реакцией циннамилового спирта с диэтилцинком , дииодметаном и хиральным дисульфонамидом в дихлорметане :
Гидроксильная группа является необходимым условием , выступающей в качестве якоря для цинка. Интерактивную 3D-модель подобной реакции можно увидеть здесь (требуется java). В другом варианте этой реакции лиганд основан на салене, и добавлена кислота Льюиса DIBAL :
Объем и ограничения
Ахирал Алкенес
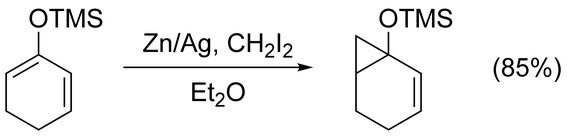
Реакция Симмонса – Смита может быть использована для циклопропаната простых алкенов без осложнений. Нефункциональные ахиральные алкены лучше всего циклопропанировать с помощью модификации Фурукавы (см. Ниже), используя Et 2 Zn и CH 2 I 2 в 1,2-дихлорэтане . Циклопропанирование алкенов, активированных электронодонорными группами, происходит быстро и легко. Например, простые эфиры енола, такие как триметилсилилокси- замещенные олефины, часто используются из-за получаемых высоких выходов.
Несмотря на электроноакцепторную природу галогенидов , многие винилгалогениды также легко циклопропанируются, давая фтор-, бром- и йодзамещенные циклопропаны.
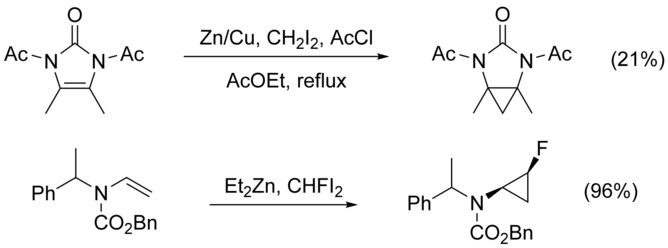
Циклопропанирование N- замещенных алкенов осложняется N- алкилированием как конкурирующим путем. Этого можно избежать, добавив защитную группу к азоту, однако добавление электроноакцепторных групп снижает нуклеофильность алкена, снижая выход. Использование высоко электрофильных реагенты , такие как CHFI 2 , вместо CH 2 I 2 , было показано , что увеличение урожайности в этих случаях.
Полиены
Без присутствия направляющей группы на олефине наблюдается очень малая хемоселективность . Однако алкен, который является значительно более нуклеофильным, чем любые другие, будет более предпочтительным. Например, циклопропанирование происходит очень избирательно по простым эфирам енола .
Совместимость функциональных групп
Важным аспектом реакции Симмонса – Смита, который способствует ее широкому использованию, является ее способность использоваться в присутствии многих функциональных групп. Среди прочего, реакция, опосредованная галогеналкилцинком, совместима с алкинами , спиртами , простыми эфирами , альдегидами , кетонами , карбоновыми кислотами и их производными, карбонатами , сульфонами , сульфонатами , силанами и станнанами . Однако обычно наблюдаются некоторые побочные реакции.
Большинство побочных реакций происходит из-за кислотности по Льюису побочного продукта ZnI 2 . В реакциях, в которых образуются чувствительные к кислоте продукты, можно добавить избыток Et 2 Zn для удаления образующегося ZnI 2 с образованием менее кислого EtZnI. Реакцию также можно остановить пиридином , который удалит ZnI 2 и избыток реагентов.
Метилирование гетероатомов также наблюдается в реакции Симмонса – Смита из-за электрофильности карбеноидов цинка. Например, использование избытка реагента в течение длительного времени реакции почти всегда приводит к метилированию спиртов. Кроме того, Et 2 Zn и CH 2 I 2 реагируют с аллильными тиоэфирами с образованием илидов серы , которые впоследствии могут претерпевать 2,3-сигматропную перегруппировку и не будут циклопропанировать алкен в той же молекуле, если не используется избыток реагента Симмонса – Смита.
Модификации
Хотя реакция Симмонса – Смита часто обсуждается в ее основной форме, был предложен ряд модификаций как цинкового катализатора, так и добавленного углерода.
Модификация Фурукавы
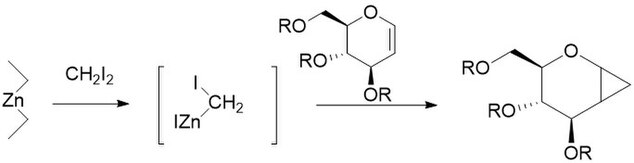
Модификация Фурукавы включает замену пары цинк-медь на диалкилцинк, наиболее активным из которых оказался Et 2 Zn . Модификация была предложена в 1968 году как способ превращения катионно-полимеризуемых олефинов, таких как простые виниловые эфиры, в их соответствующие циклопропаны. Также было обнаружено, что он особенно полезен для циклопропанирования углеводов, будучи гораздо более воспроизводимым, чем другие методы. Как и немодифицированная реакция, модифицированная Фурукава реакция стереоспецифична и часто намного быстрее, чем немодифицированная реакция. Однако реагент Et 2 Zn пирофорен , и с ним следует обращаться осторожно.
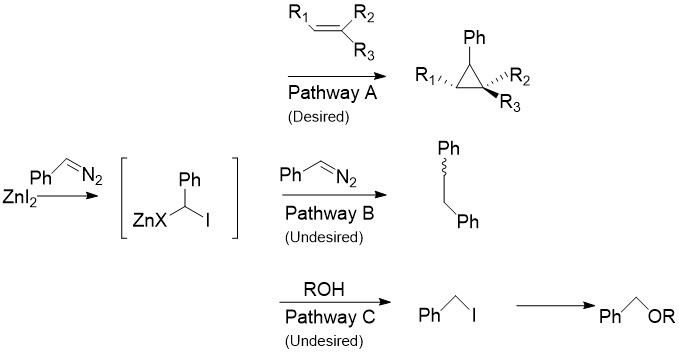
Модификация Шаретт
Модификация Шаретта заменяет CH 2 I 2, обычно обнаруживаемый в реакции Симмонса-Смита, на арилдиазосоединения, такие как фенилдиазометан , на Пути A. При обработке стехиометрическими количествами галогенида цинка образуется цинкорганическое соединение, подобное карбеноиду, описанному выше. Он может реагировать почти со всеми алкенами и алкинами, включая стиролы и спирты. Это особенно полезно, так как немодифицированный Симмонс-Смит, как известно, депротонирует спирты. К сожалению, как показано на Пути B, промежуточное соединение также может реагировать с исходным диазосоединением, давая цис- или транс- 1,2-дифенилэтен. Кроме того, промежуточное соединение может реагировать со спиртами с образованием йодфенилметана, который может дополнительно вступать в реакцию S N 2 с образованием ROCHPh, как в Пути C.
Реагенты, не содержащие цинка.
Реагенты Симмонса-Смита, которые обладают сходными с цинком реакционными свойствами, хотя и не используются обычно, были приготовлены из соединений алюминия и самария в присутствии CH 2 IX. С использованием этих реагентов аллиловые спирты и изолированные олефины могут быть избирательно циклопропанированы в присутствии друг друга. Йод- или хлорметилсамарий йодид в ТГФ является превосходным реагентом для селективного циклопропанирования аллилового спирта, предположительно направленного хелатированием на гидроксильную группу. Напротив, использование реагентов диалкил (иодметил) алюминия в CH 2 Cl 2 будет селективно циклопропанировать выделенный олефин. Специфичность этих реагентов позволяет помещать циклопропаны в полиненасыщенные системы, которые реагенты на основе цинка будут циклопропанировать полностью и неселективно. Например, i -Bu 3 Al будет циклопропанатом гераниола в положении 6, тогда как Sm / Hg будет циклопропанатом в положении 2, как показано ниже.
Однако обе реакции требуют количества исходного соединения металла, близкого к стехиометрическому, и Sm / Hg необходимо активировать высокотоксичным HgCl 2 .
Использование в синтезе
В большинстве современных приложений реакции Симмонса – Смита используется модификация Фурукавы. Ниже перечислены наиболее актуальные и надежные приложения.
Вставка с образованием γ-кетоэфиров
Модифицированный Фурукавой промежуточный циклопропановый продукт, полученный Симмонсом-Смитом, образуется при синтезе γ-кетоэфиров из β-кетоэфиров. Симмонса-Смита реагент связывается сначала к карбонильной группе , а затем к альфа- углерода от псевдо- енольной , что первые формы реакции. Этот второй реагент образует промежуточный циклопропил, который быстро фрагментируется с образованием продукта.
Образование амидоспиро [2.2] пентанов из алленамидов
Реакция Симмонса-Смита, модифицированная Фурукавой, приводит к циклопропанированию обеих двойных связей в алленамиде с образованием амидоспиро [2.2] пентанов , содержащих два циклопропильных кольца с одним атомом углерода. Также образуется продукт моноциклопропанирования.
Синтез натурального продукта
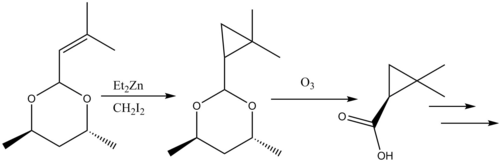
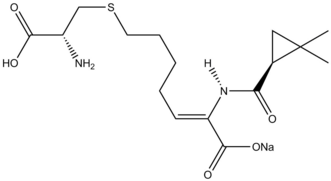
Рассмотрены реакции циклопропанирования в синтезе природных продуктов . Β-лактамаз ингибитора циластатина дает поучительный пример Симмонс-Смит в реакционной способности природного синтеза продуктов. Аллил заместитель на исходном материале Симмонса-Смита циклопропанировали, и карбоновой кислоты , затем удаляют защитную группу с помощью озонолиза с образованием предшественника .
Синтез лекарств
Реакция Симмонса – Смита используется при синтезе GSK1360707F и ропаниканта .