Копирование катящегося круга - Rolling circle replication
Подвижной круг репликации ( RCR ) представляет собой процесс однонаправленного нуклеиновой кислоты репликации , которые могут быстро синтезировать несколько копий кольцевых молекул ДНК или РНК , таких как плазмиды , в геномы из бактериофагов , и круговой РНК генома вироидов . Некоторые эукариотические вирусы также реплицируют свою ДНК или РНК по механизму катящегося круга.
В качестве упрощенной версии естественной репликации по катящемуся кругу был разработан метод изотермической амплификации ДНК, амплификация по катящемуся кругу. Механизм RCA широко используется в молекулярной биологии и биомедицинской нанотехнологии , особенно в области биосенсинга (как метод усиления сигнала).
Циркулярная репликация ДНК
Репликация ДНК по катящемуся кругу инициируется белком-инициатором, кодируемым плазмидной или ДНК бактериофага, который разрывает одну цепь двухцепочечной кольцевой молекулы ДНК в месте, называемом двухцепочечным ориджином, или DSO. Белок-инициатор остается связанным с 5'-фосфатным концом разорванной цепи, а свободный 3'-гидроксильный конец высвобождается, чтобы служить праймером для синтеза ДНК ДНК-полимеразой III . Используя неотмеченную цепь в качестве матрицы, репликация происходит вокруг кольцевой молекулы ДНК, вытесняя разорванную цепь как одноцепочечную ДНК. Смещение разорванной цепи осуществляется кодируемой хозяином геликазой, называемой PcrA (аббревиатура, обозначающая уменьшенную копию плазмиды) в присутствии белка инициации репликации плазмиды.
Непрерывный синтез ДНК может производить несколько одноцепочечных линейных копий исходной ДНК в непрерывной последовательности, называемой конкатемером . Эти линейные копии могут быть преобразованы в двухцепочечные кольцевые молекулы с помощью следующего процесса:
Во-первых, белок-инициатор делает еще один разрыв в ДНК, чтобы остановить синтез первой (ведущей) цепи. Затем РНК-полимераза и ДНК-полимераза III реплицируют одноцепочечную исходную ДНК (SSO), чтобы образовать еще один двухцепочечный круг. ДНК-полимераза I удаляет праймер, заменяя его ДНК, а ДНК-лигаза соединяет концы, образуя еще одну молекулу двухцепочечной кольцевой ДНК.
Таким образом, типичная репликация катящегося круга ДНК состоит из пяти этапов:
- Круговая дцДНК будет «разорвана».
- 3' - конец удлиняется с помощью „unnicked“ ДНК в качестве ведущей цепи (шаблон); 5 'конец смещен.
- Вытесненная ДНК представляет собой отстающую цепь и становится двухцепочечной через ряд фрагментов Окадзаки .
- Репликация как «незарегистрированной», так и смещенной оцДНК.
- Смещенная ДНК циркулирует.
Вирусология
Репликация вирусной ДНК
Некоторые ДНК-вирусы реплицируют свою геномную информацию в клетках-хозяевах посредством репликации по катящемуся кругу. Например, человеческий герпесвирус-6 (HHV-6) (hibv) экспрессирует набор «ранних генов», которые, как считается, вовлечены в этот процесс. Образующиеся длинные конкатемеры впоследствии расщепляются между участками pac-1 и pac-2 генома HHV-6 рибозимами, когда они упаковываются в отдельные вирионы.
Вирус папилломы человека-16 (ВПЧ-16) - еще один вирус, который использует скользящую репликацию для получения потомства с высокой скоростью. ВПЧ-16 инфицирует эпителиальные клетки человека и имеет двухцепочечный кольцевой геном. Во время репликации в ориджине гексамер E1 оборачивается вокруг однонитевой ДНК и перемещается в направлении от 3 'до 5'. При нормальной двунаправленной репликации два репликационных белка диссоциируют во время столкновения, но в HPV-16 считается, что гексамер E1 не диссоциирует, что приводит к непрерывной катящейся репликации. Считается, что этот механизм репликации ВПЧ может иметь физиологические последствия для интеграции вируса в хромосому хозяина и возможного развития рака шейки матки.
Кроме того, геминивирус также использует репликацию по скользящему кругу в качестве механизма репликации. Это вирус, ответственный за уничтожение многих основных сельскохозяйственных культур, таких как маниока, хлопок, бобовые, кукуруза, томаты и окра. Вирус имеет кольцевую одноцепочечную ДНК, которая реплицируется в клетках растения-хозяина. Весь процесс инициируется геминивирусным белком-инициатором репликации, Rep, который также отвечает за изменение среды хозяина, чтобы действовать как часть механизма репликации. Rep также поразительно похож на большинство других белков инициатора репликации эубактерий, с присутствием мотивов I, II и III на N-конце. Во время репликации по методу катящегося круга оцДНК геминивируса преобразуется в дцДНК, и Rep затем присоединяется к дцДНК в исходной последовательности TAATATTAC. После того, как Rep, вместе с другими белками репликации, связывается с дцДНК, он образует петлю ствола, где ДНК затем расщепляется по наномерной последовательности, вызывая смещение цепи. Это смещение позволяет репликационной вилке продвигаться в направлении от 3 'до 5', что в конечном итоге дает новую цепь оцДНК и конкатамерную цепь ДНК.
Промежуточные продукты репликации ДНК бактериофага Т4 включают кольцевые и разветвленные кольцевые конкатемерные структуры. Эти структуры, вероятно, отражают механизм репликации катящегося круга.
Репликация вирусной РНК
Некоторые РНК-вирусы и вироиды также реплицируют свой геном посредством репликации РНК по «катящемуся кругу». Для вироидов существует два альтернативных пути репликации РНК, за которыми, соответственно, следуют члены семейства Pospivirodae (асимметричная репликация) и Avsunviroidae (симметричная репликация).
В семействе Pospiviroidae (PSTVd-like) кольцевая плюс-цепь РНК транскрибируется РНК-полимеразой хозяина в олигомерные минус-цепи, а затем олигомерные плюс-цепи. Эти олигомерные плюс-цепи расщепляются хозяйской РНКазой и лигируются хозяйской РНК-лигазой для преобразования мономерной плюс-цепи кольцевой РНК. Это называется асимметричным путем репликации по катящемуся кругу. Вироиды семейства Avsunviroidae (ASBVd-подобные) реплицируют свой геном посредством симметричного пути репликации по катящемуся кругу. В этом симметричном пути олигомерные минус-цепи сначала расщепляются и лигируются с образованием мономерных минус-цепей, а затем транскрибируются в олигомерные плюс-цепи. Эти олигомерные плюс-цепи затем отщепляются и лигируются для преобразования мономерной плюс-цепи. Симметричный путь репликации был назван потому, что как положительные, так и отрицательные цепи образуются одинаково.
Расщепление олигомерных плюс и минус цепей опосредуется саморасщепляющейся структурой рибозима в виде головки молотка, присутствующей у Avsunviroidae, но такая структура отсутствует у Pospiviroidae.
Усиление катящегося круга
Производная форма репликации по катящемуся кругу успешно использовалась для амплификации ДНК из очень небольших количеств исходного материала. Этот метод усиления называется усилением по скользящему кругу (RCA). В отличие от традиционных методов амплификации ДНК, таких как полимеразная цепная реакция (ПЦР) , RCA - это метод изотермической амплификации нуклеиновых кислот, при котором полимераза непрерывно добавляет отдельные нуклеотиды к праймеру, отожженному к кольцевой матрице, что приводит к длинной конкатемерной оцДНК, содержащей от десятков до сотен тандемных повторов (дополняющих круговой шаблон).
Для проведения реакции RCA необходимы пять важных компонентов:
- ДНК-полимераза
- Подходящий буфер, совместимый с полимеразой.
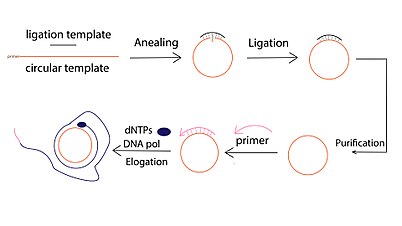
- Короткий праймер ДНК или РНК
- Круглый шаблон ДНК
- Дезоксинуклеотидтрифосфаты (дНТФ)
Полимеразы, используемые в RCA, представляют собой экзо- ДНК-полимеразу Phi29 , Bst и Vent для амплификации ДНК и РНК-полимеразу T7 для амплификации РНК. Поскольку ДНК-полимераза Phi29 имеет лучшую процессивность и способность замещения цепей среди всех вышеупомянутых полимераз, она наиболее часто использовалась в реакциях RCA. В отличие от полимеразной цепной реакции (ПЦР), RCA можно проводить при постоянной температуре (от комнатной температуры до 65 ° C) как в свободном растворе, так и на иммобилизованных мишенях (твердофазная амплификация).
Обычно реакция RCA ДНК включает три этапа:
- Циркулярное лигирование матрицы, которое может проводиться посредством ферментативного лигирования, опосредованного матрицей (например, ДНК-лигаза Т4), или лигирования без матрицы с использованием специальных ДНК-лигаз (например, CircLigase).
- Праймер- индуцированное удлинение одноцепочечной ДНК. Для гибридизации с одним и тем же кругом можно использовать несколько праймеров. В результате может быть инициировано несколько событий амплификации, в результате чего будет получено несколько продуктов RCA («Multiprimed RCA»).
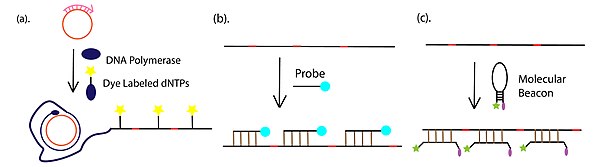
- Обнаружение и визуализация продуктов амплификации, которые чаще всего проводят с помощью флуоресцентного обнаружения, с помощью флуорофор-конъюгированных dNTP, связанных с флуорофором комплементарных или флуоресцентно меченных молекулярных маяков . Помимо флуоресцентных подходов, гель-электрофорез также широко используется для обнаружения продукта RCA.
RCA производит линейную амплификацию ДНК, поскольку каждая кольцевая матрица растет с заданной скоростью в течение определенного времени. Для увеличения выхода и достижения экспоненциальной амплификации, как это делает ПЦР, было исследовано несколько подходов. Одним из них является амплификация с гиперразветвленным катящимся кругом, или HRCA, когда добавляются и удлиняются праймеры, которые отжигаются с исходными продуктами RCA. Таким образом, исходный RCA создает больше шаблонов, которые можно усилить. Другой - круговая амплификация или C2CA, где продукты RCA перевариваются рестрикционным ферментом и лигируются в новые кольцевые матрицы с использованием рестрикционного олигонуклеотида, за которым следует новый цикл RCA с большим количеством кольцевых матриц для амплификации.
Приложения RCA
RCA может усилить единичное событие молекулярного связывания более чем в тысячу раз, что делает его особенно полезным для обнаружения мишеней со сверхнизким содержанием. Реакции RCA могут проводиться не только в среде свободного раствора, но и на твердой поверхности, такой как стекло, микрошарики или наночастицы, микропланшеты, микрофлюидные устройства или даже бумажные полоски. Эта особенность делает его очень мощным инструментом для усиления сигналов в твердофазных иммуноанализах (например, ELISA ). Таким образом, RCA становится универсальным инструментом для усиления сигнала с широким спектром приложений в геномике, протеомике, диагностике и биодатчиках.
Иммуно-RCA
Иммуно-RCA - это метод изотермического усиления сигнала для высокоспецифичного и высокочувствительного обнаружения и количественного определения белков. Этот метод объединяет два поля: RCA, который позволяет амплификацию нуклеотидов, и иммуноанализ, в котором используются антитела, специфичные к внутриклеточным или свободным биомаркерам. В результате иммуно-RCA дает специфический усиленный сигнал (высокое отношение сигнал / шум), что делает его пригодным для обнаружения, количественной оценки и визуализации белковых маркеров с низким содержанием в жидкофазных иммуноанализах и иммуногистохимии .
Иммуно-RCA следует типичной реакции иммуно-адсорбента в ELISA или иммуногистохимическом окрашивании тканей. Детектирующие антитела, используемые в реакции иммуно-RCA, модифицируются путем присоединения олигонуклеотида оцДНК к концу тяжелых цепей. Таким образом, участок Fab (фрагмент, связывание антигена) на детектирующем антителе все еще может связываться со специфическими антигенами, а олигонуклеотид может служить праймером для реакции RCA.
Типичная процедура иммуно-RCA, опосредованная антителами, выглядит следующим образом:
1. Детектирующее антитело распознает конкретную белковую мишень. Это антитело также прикреплено к олигонуклеотидному праймеру.
2. Когда присутствует кольцевая ДНК, она отжигается, и праймер совпадает с комплементарной последовательностью кольцевой ДНК.
3. Комплементарная последовательность кольцевой ДНК-матрицы копируется сотни раз и остается прикрепленной к антителу.
4. Выход RCA (удлиненная оцДНК) обнаруживается флуоресцентными зондами с использованием флуоресцентного микроскопа или считывающего устройства для микропланшетов.
Иммуно-RCA на основе аптамеров
В дополнение к опосредованной антителами иммуно-RCA праймер оцДНК RCA также может быть конъюгирован с 3'-концом ДНК-аптамера. Хвост праймера можно амплифицировать с помощью амплификации по катящемуся кругу. Продукт можно визуализировать посредством маркировки флуоресцентного репортера. Процесс показан на рисунке справа.
Другие приложения RCA
Различные производные RCA широко использовались в области биосенсинга. Например, RCA успешно использовался для обнаружения наличия вирусной и бактериальной ДНК из клинических образцов, что очень полезно для быстрой диагностики инфекционных заболеваний . Он также использовался в качестве метода усиления сигнала на чипе для анализа микрочипов нуклеиновых кислот (как для ДНК, так и для РНК) .
В дополнение к функции амплификации в приложениях биочувствительности, метод RCA может быть применен также для создания наноструктур ДНК и гидрогелей ДНК . Продукты RCA также можно использовать в качестве темплатов для периодической сборки наноразмеров или белков, синтеза металлических нанопроволок и образования наноостровков .
Смотрите также
использованная литература
внешние ссылки
- Системы репликации ДНК, используемые с небольшими кольцевыми молекулами ДНК. Genomes 2 , T. Brown et al., В NCBI Books.
- MicrobiologyBytes: Вироиды и вирусоиды
- http://mcmanuslab.ucsf.edu/node/246