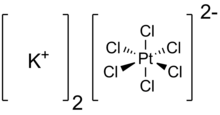
Гексахлороплатинат калия - Potassium hexachloroplatinate
|
|

|
|
| Идентификаторы | |
|---|---|
|
3D модель ( JSmol )
|
|
| ECHA InfoCard |
100.037.239 |
|
PubChem CID
|
|
| Номер RTECS | |
| UNII | |
|
Панель управления CompTox ( EPA )
|
|
|
|
| Характеристики | |
| К 2 PtCl 6 | |
| Молярная масса | 485,99 г / моль |
| Появление | от оранжевого до желтого твердого вещества |
| Плотность | 3,344 г / см 3 |
| Температура плавления | 250 ° С (482 ° F, 523 К) (разлагается) |
| 0,89 г / 100 мл H 2 O (при 25 ° C) | |
|
Произведение растворимости ( K уд )
|
7,48 × 10 −6 |
| Опасности | |
| Паспорт безопасности | Оксфордский паспорт безопасности материалов |
|
Классификация ЕС (DSD) (устаревшая)
|
Токсичный (T) |
| точка возгорания | 250 ° С (482 ° F, 523 К) |
| Родственные соединения | |
|
Другие анионы
|
Тетрахлороплатинат калия |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
Гексахлороплатинат калия представляет собой неорганическое соединение с формулой K 2 PtCl 6 . Это желтое твердое вещество, которое является примером сравнительно нерастворимой соли калия. Соль содержит дианион гексахлороплатината (IV), который имеет октаэдрическую координационную геометрию .
Осаждение этого соединения из растворов платинохлористоводородной кислоты ранее использовалось для определения калия гравиметрическим анализом . Он также полезен в качестве промежуточного продукта при извлечении платины из отходов.
Реакции
Используя реакции метатезиса солей , гексахлороплатинат калия превращается во множество четвертичных аммониевых и родственных липофильных солей. К ним относятся тетрабутиламмониевая соль (NBu 4 ) 2 PtCl 6 , известная как катализатор Люкевикса .
Восстановление гексахлороплатината калия дигидрохлоридом гидразина дает соответствующую тетрахлороплатинатную соль .
использованная литература
- ^ Гринберг, AA; Сибирская, В.В. (1967). «Растворимость комплексов гексаммина и гексагалогенплатины (IV)». Журнал неорганической химии . 12 : 2069–2071.
- ↑ Джон Рамбл (18 июня 2018 г.). CRC Справочник по химии и физике (99 изд.). CRC Press. С. 5–189. ISBN 1138561630.
- ^ GF Smith; Дж. Л. Гринг (1933). «Разделение и определение щелочных металлов с использованием хлорной кислоты. V. Хлорная кислота и хлороплатиновая кислота в определении малых количеств калия в присутствии больших количеств натрия». Варенье. Chem. Soc. 55 (10): 3957–3961. DOI : 10.1021 / ja01337a007 .
- ^ Джордж Б. Кауфман, Ларри А. Тетер "Извлечение платины из лабораторных остатков" неорганических синтезов, 1963, том 7, стр. 232-236. DOI : 10.1002 / 9780470132388.ch61
- ^ Iovel, IG; Гольдберг, Ю.С.; Шиманская М.В.; Люкевичс, Э. (1987). "Гексахлороплатинаты четвертичного ония: новые катализаторы гидросилилирования". Металлоорганические соединения . 6 (7): 1410–1413. DOI : 10.1021 / om00150a007 .CS1 maint: использует параметр авторов ( ссылка )
- ^ Джордж Б. Кауфман, Дуэйн А. Коуэн (1963). «Цис- и транс-дихлордиамминплатина (II)». цис- и транс-дихлордиаммин платина (II) . Неорганические синтезы. 7 . С. 239–245. DOI : 10.1002 / 9780470132388.ch63 . ISBN 9780470132388.CS1 maint: использует параметр авторов ( ссылка )
- ^ Келлер, RN; Меллер, Т. (1963). «Тетрахлороплатинат (II) калия». Неорг. Synth. 7 : 247–250. DOI : 10.1002 / 9780470132333.ch79 .
