Феррат калия - Potassium ferrate
|
|

|
|
| Имена | |
|---|---|
|
Название ИЮПАК
Феррат калия (VI)
|
|
| Другие имена
Калий феррат
Дикалия феррат |
|
| Идентификаторы | |
|
3D модель ( JSmol )
|
|
|
PubChem CID
|
|
|
|
|
|
| Характеристики | |
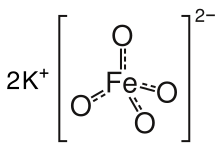
| К 2 FeO 4 | |
| Молярная масса | 198,0392 г / моль |
| Появление | Темно-пурпурное твердое вещество |
| Плотность | 2,829 г / см 3 , твердый |
| Температура плавления | > 198 ° C (температура разложения) |
| растворим в 1М КОН | |
| Растворимость в других растворителях | реагирует с большинством растворителей |
| Состав | |
| K 2 SO 4 мотив | |
| Тетраэдр | |
| 0 Д | |
| Опасности | |
| Основные опасности | Окислитель |
| Паспорт безопасности | Внешний SDS |
| Пиктограммы GHS |

|
| Сигнальное слово GHS | Опасность |
| H272 | |
| P210 , P220 , P221 , P280 , P370 + 378 , P501 | |
| точка возгорания | негорючий |
| Родственные соединения | |
|
Другие анионы
|
K 2 MnO 4 K 2 CrO 4 K 2 RuO 4 |
|
Другие катионы
|
BaFeO 4 Na 2 FeO 4 |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
Феррат калия - это химическое соединение с формулой K 2 FeO 4 . Это фиолетовый соль является парамагнитным , и является редким примером железа (VI) соединения. В большинстве своих соединений железо имеет степень окисления +2 или +3 (Fe 2+ или Fe 3+ ). Благодаря высокой степени окисления FeO 4 2– является мощным окислителем .
Синтез и структура
Георг Эрнст Шталь (1660-1734) первым обнаружил, что остаток образуется при воспламенении смеси нитрата калия (селитры) и порошка железа, растворенного в воде, с образованием пурпурного раствора. Эдмон Фреми (1814 - 1894) позже обнаружил, что синтез гидроксида калия и оксида железа (III) в воздухе дает соединение, растворимое в воде:
- 4KOH + Fe 2 O 3 + 3O → 2K 2 FeO 4 + 2H 2 O
Состав соответствовал таковому манганату калия . В лаборатории K 2 FeO 4 получают путем окисления щелочного раствора соли железа (III) концентрированным хлорным отбеливателем .:
- 3ClO - + 3Fe (OH) 3 (H 2 O) 3 + 4K + + 4OH - → 3Cl - + 2K 2 FeO 4 + 11H 2 O
Соль изоструктурна K 2 MnO 4 , K 2 SO 4 и K 2 CrO 4 . Твердое вещество состоит из K + и тетраэдрического аниона FeO 4 2- с расстояниями Fe-O 1,66 Å. Также известна плохо растворимая бариевая соль BaFeO 4 .
Свойства и приложения
Основная трудность использования K 2 FeO 4 заключается в том, что он часто слишком реакционноспособен, о чем свидетельствует тот факт, что он разлагается при контакте с водой, особенно в кислой воде:
- 4 K 2 FeO 4 + 4 H 2 O → 3 O 2 + 2 Fe 2 O 3 + 8 КОН
При высоком pH водные растворы стабильны. Растворы темно-фиолетового цвета внешне похожи на перманганат калия ( KMnO
4). Это более сильный окислитель, чем последний. В виде сухого твердого вещества K 2 FeO 4 стабилен.
Поскольку побочными продуктами окислительно-восстановительных реакций являются оксиды железа, подобные ржавчине, K 2 FeO 4 был описан как « зеленый окислитель ». Он использовался при очистке сточных вод в качестве окислителя органических загрязнителей и биоцида . Обычно образующийся продукт реакции представляет собой оксигидроксид железа (III), отличный флокулянт . В органическом синтезе K 2 FeO 4 окисляет первичные спирты . Напротив, родственные окислители, такие как хромат , считаются опасными для окружающей среды.
K 2 FeO 4 также привлек внимание как потенциальный катодный материал в « супер железной батарее ».
Стабилизированные формы феррата калия были предложены для удаления трансурановых частиц, как растворенных, так и суспендированных, из водных растворов. Количество тоннажа было предложено, чтобы помочь устранить последствия чернобыльской катастрофы в Беларуси. Этот новый метод был успешно применен для удаления широкого спектра тяжелых металлов.
Работа по использованию феррата калия для осаждения трансурановых соединений и тяжелых металлов проводилась в лабораториях IC Technologies Inc. в партнерстве с ADC Laboratories с 1987 по 1992 год. Удаление трансурановых частиц проводилось на образцах из различных департаментов США. Энергетические ядерные объекты в США.
Он был предложен в качестве остановки кровотечения для свежих ран.

