Полиоксометаллат - Polyoxometalate
В химии , A полиоксометаллат (сокращенно П ) представляет собой многоатомный ион , как правило, анион , который состоит из трех или более переходных металлов оксианионов , связанных между собой общих кислородных атомами , образуют замкнутые 3-мерные структуры. Атомы металлов обычно представляют собой переходные металлы группы 6 (Mo, W) или, реже, группы 5 (V, Nb, Ta) в их высоких степенях окисления . Обычно это бесцветные или оранжевые диамагнитные анионы . Различают два широких семейства: изополиметаллаты, состоящие только из одного типа металла и оксида , и гетерополиметалаты , состоящие из одного металла, оксида и оксианиона основной группы ( фосфат , силикат и т. Д.). Из этих общих утверждений существует множество исключений.
Формирование
Оксиды металлов d 0, такие как V 2 O 5 , MoO 3 , WO 3, растворяются при высоком pH с образованием ортометалатов, VO3-
4, MoO2-
4, WO2-
4. Для Nb 2 O 5 и Ta 2 O 5 природа растворенных частиц при высоком pH менее ясна, но эти оксиды также образуют полиоксометаллаты. При понижении pH протонат ортометалата образует оксидно-гидроксидные соединения, такие как W (OH) O-
3и V (OH) O2-
3. Эти виды конденсируются посредством процесса, называемого олатированием . Замена концевых связей M = O, которые фактически имеют характер тройной связи, компенсируется увеличением координационного числа. Несоблюдение полиоксохроматных каркасов объясняется малым радиусом Cr (VI), который может не соответствовать октаэдрической координационной геометрии.
Конденсация M (OH) On−
3виды влечет за собой потерю воды и образование связей M – O – M. Стехиометрия гексамолибдата показана:
- 6 MoO 4 2- + 10 HCl → [Mo 6 O 19 ] 2- + 10 Cl - + 5 H 2 O
Сокращенная последовательность конденсации, проиллюстрированная ванадатами:
- 4 ВО3-
4+ 8 H + → V
4О4-
12+ 4 Н 2 О -
2+1 ⁄ 2 В
4О4-
12+ 6 H + → V
10О
26 год(ОЙ)4-
2+ 2 Н 2 О
Когда такое подкисление проводят в присутствии фосфата или силиката , получается гетерополиметалат. Например, фосфовольфрамат-анион PW
12О3-
40состоит из двенадцати октаэдрических оксианионов вольфрама, окружающих центральную фосфатную группу.
История
Фосфомолибдат аммония , PMo
12О3-
40анион, был описан в 1826 году. Изоструктурный фосфовольфраматный анион был охарактеризован рентгеновской кристаллографией в 1934 году. Эта структура названа структурой Кеггина в честь ее первооткрывателя.
В 1970-е годы появились четвертичные аммониевые соли ПОМ. Это нововведение позволило проводить систематические исследования без осложнений, связанных с гидролизом и кислотно-основными реакциями. Внедрение спектроскопии ЯМР 17 O позволило определить структурные характеристики ПОМ в растворе.
Рамаццоит , первый образец минерала с катионом полиоксометаллата, был описан в 2016 году на руднике Маунт Рамаццо, Лигурия, Италия .
Структура и склеивание
Типичные строительные блоки каркаса представляют собой многогранные блоки с 6-координатными металлическими центрами. Обычно эти блоки имеют общие ребра и / или вершины. Координационное число оксидных лигандов варьируется в зависимости от их расположения в клетке. Поверхностные оксиды обычно представляют собой концевые оксолиганды или оксо-лиганды с двойными связями . Внутренние оксиды обычно бывают трехкомпонентными или даже октаэдрическими. ПОМ иногда рассматривают как растворимые фрагменты оксидов металлов .
Повторяющиеся структурные мотивы позволяют классифицировать ПОМ. Изо- полиоксометаллаты (изополианионы) имеют октаэдрические металлические центры. В heteropolymetalates образует различные структуры , так как основная группа в центр, как правило , четырехгранный. Структуры Линдквиста и Кеггина являются общими мотивами для изо- и гетерополианионов соответственно.
Полиоксометаллаты обычно обладают координационными связями металл-оксо различной кратности и прочности. В типичном ПОМ, таком как структура Кеггина PW
12О3-
40, каждый аддендный центр соединяется с одним концевым оксо-лигандом, четырьмя мостиковыми лигандами µ 2 -O и одним мостиковым µ 3 -O, происходящим от центральной гетерогруппы. Связи металл – металл в полиоксометаллатах обычно отсутствуют, и благодаря этому свойству Ф. Альберт Коттон выступил против рассмотрения полиоксометаллатов как формы кластерных материалов . Однако связи металл-металл не полностью отсутствуют в полиоксометаллатах, и они часто присутствуют среди сильно восстановленных частиц.
|

|

|
|

|
|
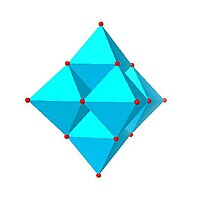
Гексамолибдат Линдквиста, Мо 6О2- 19 |
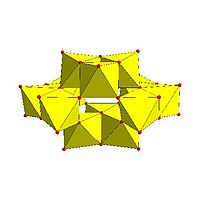
Декаванадат , V 10О6- 28 |
Штриховой рисунок декаванадата динатрия, V 10О6- 28 |
Паравольфрамат B, H 2W 12О10- 42 |
Mo 36 -полимолибдат, Mo 36О 112(ЧАС 2O)8- 16 |
Полимолибдаты и вольфраматы
Полимолибдаты и поливольфраматы являются производными, по крайней мере формально, из дианионных предшественников [MO 4 ] 2- . Наиболее распространенными звеньями для полимолибдатов и полиоксовольфраматов являются октаэдрические центры {MO 6 }, иногда слегка искаженные. Некоторые полимолибдаты содержат пятиугольные бипирамидальные звенья. Эти строительные блоки находятся в молибденовой синеве , которая представляет собой соединения со смешанной валентностью .
Полиоксотанталаты, ниобаты и ванадаты
Полиниобаты, политанталаты и ванадаты являются производными, по крайней мере формально, из высокозаряженных предшественников [MO 4 ] 3- . Для Nb и Ta наиболее распространенными членами являются M
6О8-
19(M = Nb, Ta), которые принимают структуру Линдквиста. Эти октаанионы образуются в сильно основных условиях из щелочных расплавов протяженных оксидов металлов (M 2 O 5 ) или, в случае Nb, даже из смесей ниобиновой кислоты и гидроксидов щелочных металлов в водном растворе. Гексатанталат также можно получить конденсацией пероксотанталата Ta (O
2)3-
4в щелочной среде. Эти полиоксометаллаты демонстрируют аномальную тенденцию растворимости в воде их солей щелочных металлов, поскольку их соли Cs + и Rb + более растворимы, чем их соли Na + и Li + . Противоположная тенденция наблюдается в ПОМ 6-й группы.
Декаметалаты с формулой M
10О6-
28(M = Nb, Ta) изоструктурны декаванадату. Они образованы исключительно октаэдрами {MO 6 } с общими ребрами (структура декавольфрамата W
10О4-
32 состоит из вольфрамовых октаэдров с общими ребрами и общими углами).
Гетероатомы
Гетероатомы помимо переходного металла являются определяющей особенностью гетерополиметаллатов . Многие различные элементы могут служить гетероатомами, но наиболее распространенными являются ПО.3-
4, SiO4-
4, и AsO3-
4.
Гигантские сооружения

Полиоксомолибдаты включают анионы молибденового синего в форме колеса и сферические кеплераты. Кластер [Mo 154 (NO) 14 O 420 (OH) 28 (H 2 O) 70 ] ~ 20- состоит из более чем 700 атомов и размером с небольшой белок. Анион имеет форму шины (диаметр полости более 20 Å) и имеет чрезвычайно большую внутреннюю и внешнюю поверхность.
Оксоалкоксометаллаты
Оксоалкоксометаллаты представляют собой кластеры, содержащие как оксидные, так и алкоксидные лиганды. Обычно в них отсутствуют концевые оксолиганды. Примеры включают додекатитанат Ti 12 O 16 (OPri) 16 (где OPri означает алкоксигруппу ), оксоалкоксометаллаты железа и ионы Кеггина железа и меди.
Сульфидо, имидо и другие оксометаллаты с замещенными О
Концевые оксидные центры полиоксометаллата структура может в некоторых случаях быть заменены другими лигандами, такими как S 2- , Br - и NR 2- . Серозамещенные ПОМ называются полиоксотиометаллатами . Также были продемонстрированы другие лиганды, заменяющие ионы оксида, такие как нитрозильная и алкоксильная группы.
Полифтороксометаллаты представляют собой еще один класс оксометаллатов с О-замещением.
Другой
Многочисленные гибридные органо-неорганические материалы, содержащие ядра из ПОМ,
Иллюстрацией разнообразных структур ПОМ является ион CeMo
12О8-
42, который имеет общие октаэдры с атомами Mo в вершинах икосаэдра).
Использование и желательные приложения
Катализаторы окисления
ПОМ используются в качестве промышленных катализаторов окисления органических соединений.
Продолжаются попытки расширить эту тему. Аэробное окисление на основе ПОМ продвигалось как альтернатива процессам отбеливания древесной массы на основе хлора , методу обеззараживания воды и методу каталитического производства муравьиной кислоты из биомассы ( процесс OxFA ). Было показано, что полиоксометаллаты катализируют расщепление воды .
Молекулярная электроника
Некоторые ПОМ демонстрируют необычные магнитные свойства, что послужило поводом для появления многих приложений. Один из примеров - устройства хранения, называемые кубитами . компоненты энергонезависимой (постоянной) памяти , также известные как устройства флэш-памяти .
Наркотики
Возможные противоопухолевые и противовирусные препараты. Полиоксомолибдаты и гептамолибдаты типа Андерсона проявляют активность по подавлению роста некоторых опухолей. В случае (NH 3 Pr) 6 [Mo 7 O 24 ] активность, по-видимому, связана с его окислительно-восстановительными свойствами. Структура Уэллса-Доусона может эффективно ингибировать агрегацию амилоида β (Aβ) в терапевтической стратегии болезни Альцгеймера. антибактериальное и противовирусное применение.
использованная литература
дальнейшее чтение
- Длинный, DL; Burkholder, E .; Кронин, Л. (2007). «Полиоксометаллатные кластеры, наноструктуры и материалы: от самосборки до конструкционных материалов и устройств». Chem. Soc. Ред . 36 (1): 105–121. DOI : 10.1039 / b502666k . PMID 17173149 .
- Папа, МП; Мюллер, А. (1991). «Химия полиоксометаллата: старая область с новыми измерениями в нескольких дисциплинах». Энгью. Chem. Int. Эд. Англ . 30 : 34–48. DOI : 10.1002 / anie.199100341 .
- Хилл, CL (1998). «Специальный том о полиоксометаллатах» . Chem. Ред . 98 (1): 1-2. DOI : 10.1021 / cr960395y . PMID 11851497 .
- Cronin, L .; Мюллер, А. (2012). Cronin, L .; Мюллер, А. (ред.). «Спецвыпуск по полиоксометаллатам». Chem. Soc. Ред . 2012 (22): 7325–7648. DOI : 10.1039 / C2CS90087D . PMID 23052289 .


