Нейродегенерация, связанная с пантотенаткиназой - Pantothenate kinase-associated neurodegeneration
| Нейродегенерация, связанная с пантотенаткиназой | |
|---|---|
| Другие имена | Нейродегенерация с накоплением железа в мозге 1 |
 | |
| Пантетеин | |
| Специальность | Неврология |
| Симптомы | Дистония, паркинсонизм, деменция |
| Обычное начало | До 10 лет (классический), Более 10 лет (нетипичный) |
| Типы | Классический, нетипичный |
| Причины | Мутация PANK2 |
| Частота | 1–3 на 1 млн человек |
Пантотената киназа-ассоциированная нейродегенерация ( PKAN ), ранее называемый синдромом Hallervorden-Шпатец, является генетическим дегенеративным заболеванием в головном мозге , что может привести к паркинсонизму , дистония , деменции , и в конечном итоге смерти. Нейродегенерация при PKAN сопровождается избытком железа, которое постепенно накапливается в головном мозге.
Признаки и симптомы
Симптомы обычно начинаются в детстве и прогрессируют, часто приводя к смерти в раннем взрослом возрасте. Симптомы PKAN проявляются до среднего возраста и чаще всего замечаются до 10 лет. Симптомы включают:
- дистония (повторяющиеся неконтролируемые сокращения мышц, которые могут вызвать подергивание или скручивание определенных групп мышц)
- дисфагия и дизартрия из-за вовлеченных в речь групп мышц
- ригидность / скованность конечностей
- тремор
- извивающиеся движения
- слабоумие
- спастичность
- слабость
- судороги (редко)
- ходьба на носках
- пигментный ретинит , другое дегенеративное заболевание, которое поражает сетчатку человека , часто вызывая изменение цвета сетчатки и прогрессирующее ухудшение сетчатки, сначала вызывая куриную слепоту, а затем приводя к полной потере зрения.
25% людей испытывают нехарактерную форму PKAN, которая развивается после 10 лет и имеет более медленные, более постепенные темпы ухудшения, чем у лиц до 10 лет. Эти люди сталкиваются со значительными нарушениями речи, а также с психическими и поведенческими расстройствами.
Будучи прогрессирующим дегенеративным нервным заболеванием, PKAN приводит к ранней неподвижности и часто к смерти в раннем взрослом возрасте. Смерть наступает преждевременно из-за таких инфекций, как пневмония, и болезнь сама по себе технически не ограничивает жизнь.
Генетика
PKAN - аутосомно- рецессивное заболевание. Оба родителя больного ребенка должны быть гетерозиготными носителями болезни и, следовательно, должны нести один мутантный аллель . Поскольку это аутосомное заболевание, у гетерозиготных по заболеванию лиц могут не проявляться какие-либо атипичные характеристики, которые могут указывать на это расстройство, однако были зарегистрированы случаи сложной гетерозиготности, при которых у гетерозиготных людей действительно развивается классическая форма заболевания.
Заболевание вызвано мутантным геном PANK2 , расположенным в хромосомном локусе : 20p13-p12.3. PANK2 отвечает за кодирование протеина пантотенаткиназы 2. PANK2 кодирует фермент пантотенаткиназу, и мутации в гене приводят к врожденной ошибке метаболизма витамина B5 (пантотената). Витамин B5 необходим для производства кофермента А в клетках. Нарушение этого фермента влияет на энергетический и липидный обмен и может привести к накоплению потенциально вредных соединений в мозгу, включая железо.
PANK2 кодирует транскрипт размером 1,85 КБ, который происходит из семи экзонов, покрывающих общее расстояние примерно 3,5 МБ геномной ДНК. Ген PANK2 также кодирует 50,5-кДа белок , который является функциональным пантотенат киназа , существенный регуляторный фермент в кофермента А (КоА) биосинтеза, а также катализировать фосфорилирование пантотенат ( витамин В 5 ), N-pantothenoyl-цистеин и pantetheine ( OMIM).
Белки, кодируемые мутантным геном PANK2, часто вызываются нулевыми или миссенс-мутациями, в первую очередь делецией 7bp в кодирующей последовательности гена PANK2 .
Об этом расстройстве сообщалось в определенных сообществах, основанных на внутриобщинных браках, где оба родителя ребенка являются носителями одной и той же мутации. Одним из сообщаемых сообществ является сообщество Агравал (Agarwal), в основном базирующееся в северной части Индии. Известной мутацией в сообществе Agarwal является патогенная мутация 1c.215_216insA в гене PANK2. В некоторых лабораториях это также кодируется как chr20: 3870292-3870293insA. Это приводит к сдвигу рамки считывания и преждевременному усечению белка из 47 аминокислот ниже кодона 183 (p.Arg183GlufsTer47; ENST00000316562).
Диагностика
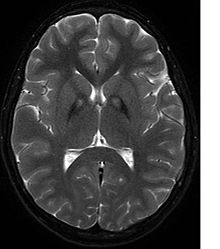
Неврологическое обследование покажет признаки ригидности мышц; слабость; и ненормальные позы, движения и тремор. Если пострадали и другие члены семьи, это может помочь в определении диагноза. Генетические тесты могут подтвердить аномальный ген, вызывающий заболевание. Однако этот тест еще не получил широкого распространения. Необходимо исключить другие двигательные нарушения и заболевания. Людей, проявляющих какие-либо из перечисленных выше симптомов, часто проверяют с помощью МРТ (магнитно-резонансной томографии) для выявления ряда нейро-связанных расстройств. МРТ обычно показывает отложения железа в базальных ганглиях . Разработка диагностических критериев продолжается в надежде на дальнейшее отделение PKAN от других форм нейродегенеративных заболеваний с участием NBIA.
Невропатология
Микроскопическая черта PKAN включает высокие уровни железа в бледном шаре и Рагз геисиЫы из черной субстанции , очевидные в качестве характерной ржавчины-коричневого цвета в шаблоне называемых глаз-оф-тигр знак; липофусцин и нейромеланин, сконцентрированные в областях накопления железа; овальные безъядерные структуры, представляющие набухшие аксоны, цитоплазма которых набухает вакуолями , называемые сфероидами , схолленами аксонов или нейроаксональной дистрофией ; и тельца Леви .
Уход
Было показано, что фосфопантотенат лечит PKAN у человека, а также на мышиной модели заболевания. Пантетин (предшественник пантетеина ) был изучен и показал его эффективность на мышах и на модели заболевания плодовой мухи .
Прогноз
Показатели выживаемости для тех, у кого был диагностирован типичный PKAN и которые не лечили, составляет 11,18 лет со стандартным отклонением 7,8 года. Было проведено исследование, сообщающее о хороших результатах у одного пациента с поздним началом PKAN.
Эпидемиология
Данные о распространенности этого расстройства остаются неполными, однако, по оценкам, от 1 из 1000000 до 3 из 1000000 человек страдают этим расстройством (на основе наблюдаемых случаев в популяции), но, опять же, это только приблизительная оценка заболевания. настолько редок, что его сложно точно установить статистически.
История
PKAN был впервые описан Hallervorden и Spatz (1922). Их открытие было связано с диагнозом, который был поставлен семье из 12 человек, в которой пять сестер страдали прогрессирующим слабоумием и дизартрией. Вскрытие выявило коричневые пятна в различных областях мозга (особенно интересными были области бледного шара и черного вещества). Дальнейшее исследование и описание было проведено Мейером (1958), который диагностировал 30 отдельных случаев ПКАН. Meyer (1958) последовали Elejalde et al. (1978), который описал 5 затронутых членов семьи и выдвинул гипотезу о том, что заболевание возникло в Центральной Европе , подтвердив свою гипотезу клиническим и генетическим анализом. Дальнейшие исследования и идеи были предоставлены Malmstrom-Groth и Kristensson (1982) и Jankovic et al. (1985).
Диагностика PKAN стала важной вехой с появлением МРТ, а также подробным описанием этих МРТ, предоставленным Littrup и Gebarski (1985), Tanfani et al. (1987), Sethi et al. (1988), Angelini et al. (1992), Casteels et al. (1994) и Malandrini et al. (1995). Ген был локализован на хромосоме 20p Taylor et al. (1996), которые предположили, что это заболевание следует называть нейродегенерацией с накоплением железа в мозге (NBIA1), чтобы избежать нежелательного эпонима Hallervorden-Spatz. Заболевание было переименовано в «нейродегенерацию, связанную с пантотенаткиназой» или PKAN Zhou et al. (2001), которые предложили название, чтобы избежать неправильного толкования и лучше отразить истинную природу расстройства. Совсем недавно Pellecchia et al. (2005) опубликовали отчет о 16 пациентах, страдающих PKAN, подтвержденный генетическим анализом.
использованная литература
внешние ссылки
| Классификация | |
|---|---|
| Внешние ресурсы |