Озанимод - Ozanimod
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Zeposia |
| Другие названия | RPC-1063 |
| AHFS / Drugs.com | Монография |
| MedlinePlus | a620029 |
| Данные лицензии | |
Категория беременности |
|
| Пути администрирования |
Устно |
| Код УВД | |
| Правовой статус | |
| Правовой статус | |
| Фармакокинетические данные | |
| Ликвидация Период полураспада | 19 часов |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ECHA InfoCard |
100.247.081 |
| Химические и физические данные | |
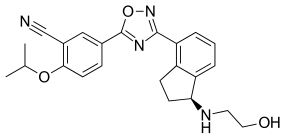
| Формула | C 23 H 24 N 4 O 3 |
| Молярная масса | 404,470 г · моль -1 |
| 3D модель ( JSmol ) | |
| |
| |
Озанимод , продаваемый под торговой маркой Zeposia , представляет собой иммуномодулирующий препарат для лечения рецидивирующего рассеянного склероза (RMS) и язвенного колита . Он действует как агонист рецептора сфингозин-1-фосфата (S1P) , изолируя лимфоциты в периферических лимфоидных органах и вдали от участков хронического воспаления.
Наиболее частыми побочными реакциями являются инфекция верхних дыхательных путей, повышение уровня печеночных трансаминаз, ортостатическая гипотензия, инфекция мочевыводящих путей, боль в спине и гипертония.
Озанимод был одобрен для медицинского применения в США в марте 2020 года, в Европейском союзе в мае 2020 года и в Австралии в июле 2020 года.
Медицинское использование
В Соединенных Штатах озанимод показан для лечения взрослых с рецидивирующими формами рассеянного склероза (РС), включая клинически изолированный синдром, ремиттирующую болезнь и активное вторично прогрессирующее заболевание; и с активным язвенным колитом (ЯК) от умеренной до тяжелой степени.
В Европейском Союзе и в Австралии озанимод показан для лечения взрослых с рецидивирующим ремиттирующим рассеянным склерозом (RRMS).
Фармакология
Фармакодинамика
Озанимод является агонистом рецепторов S1P1 и S1P5. Он демонстрирует этот эффект в зависимости от дозы, с 10-кратной эффективностью для трех препаратов сравнения. Это улучшение селективности по сравнению с его предшественником, финголимодом , который неспецифичен для всех 5 изотипов. Агонизм S1P напрямую вызывает его интернализацию и деградацию через убиквитин- протеосомный путь. Потеря S1P приводит к снижению общего количества лимфоцитов в циркуляции, особенно CD4 + CCR7 + и CD8 + CCR7 + Т-клеток.
Фармакокинетика.
Озанимод имеет высокую пероральную биодоступность, период полувыведения из кровотока около 19 часов и достигает максимальной концентрации в плазме крови примерно через 6 часов. Озанимод дегидрируется двумя ферментами CYP до двух активных метаболитов, все со сходной фармакокинетикой. Уменьшение количества лимфоцитов продолжается примерно 14 дней после прекращения лечения. В отличие от финголимода, он не требует фосфорилирования для активации и не демонстрирует сердечных аномалий или гепатотоксичности.
История
Озанимод был обнаружен Исследовательским институтом Скриппса и лицензирован биотехнологической компанией Receptos Inc., которая была приобретена Celgene Corp, а затем приобретена Bristol Myers Squibb .
США пищевых продуктов и медикаментов (FDA) одобрило ozanimod на основе данных двух клинических испытаний (Trial 1 / NCT02294058 и Trial 2 / NCT02047734) 1767 субъектов с рецидивирующих форм рассеянного склероза. Испытания проводились в 173 центрах в США, Беларуси, Польше, России и Украине. Субъекты получали озанимод или препарат сравнения ( интерферон β1a , продукт, одобренный для лечения рецидивирующих форм рассеянного склероза) на срок до одного года (в испытании 1) или до двух лет (в испытании 2). Ни испытуемые, ни медицинские работники не знали, какое лечение проводится, пока испытания не были завершены. Польза озанимода оценивалась на основании процента субъектов, у которых наблюдалось уменьшение рецидивов заболевания по сравнению с субъектами, получавшими интерферон β1a.
В мае 2021 года FDA одобрило озанимод в качестве дополнительной индикации для лечения умеренно-тяжелого активного язвенного колита.
Клинические испытания
Оселок
Touchstone - это двойная слепая плацебо-контролируемая клиническая фаза II для лечения язвенного колита. Было набрано 197 пациентов в возрасте 18–75 лет с умеренным и тяжелым ЯК (оценка Майо 6–10), которым назначали либо плацебо, либо 0,5 мг или 1 мг озанимода перорально с последующим повышением дозы в течение 1 недели. Доза 1 мг показала небольшое увеличение скорости клинической ремиссии ЯК и уменьшение общего количества лимфоцитов по сравнению с плацебо, при этом наиболее частыми побочными эффектами были головные боли и анемия. Авторы отметили, что ограничения этого исследования включали короткую продолжительность и небольшой размер выборки, что означает, что они не могли оценить безопасность или эффективность.
Сияние
Radiance - это двойное слепое плацебо-контролируемое комбинированное клиническое исследование II / III фазы по лечению рецидивирующего рассеянного склероза. Для фазы II исследования 258 пациентам в возрасте 18–55 лет с RMS (средняя расширенная шкала инвалидности 2,9) было назначено либо плацебо, либо 0,5 мг, либо 1 мг озанимода перорально с последующим повышением дозы в течение 1 недели. Озанимод значительно снизил активность поражений при МРТ у участников с рецидивирующим рассеянным склерозом в течение 24 недель. Обе дозы озанимода достигли ожидаемого диапазона снижения количества лимфоцитов на 60-70% и хорошо переносились, с профилем безопасности, соответствующим предыдущему исследованию фазы 1 на здоровых добровольцах. Наиболее частыми побочными эффектами по сравнению с плацебо были: назофарингит, головная боль и инфекции мочевыводящих путей без серьезных инфекционных или сердечных побочных эффектов. С этими результатами обе дозы озанимода были включены в двухлетнее испытание фазы III, которое завершено, но не опубликовано по состоянию на ноябрь 2016 года.
Солнечный лучик
Sunbeam - это второе клиническое исследование фазы III RMS, в котором установлена оптимальная доза для оптимального соотношения безопасности и пользы, с расчетным размером 1200 пациентов; оно началось в ноябре 2014 года и имеет предполагаемую дату завершения в феврале 2017 года.
Общество и культура
Коммерческий
После выхода на биржу в мае 2013 года акции Receptos, Inc. резко выросли благодаря клиническим данным ozanimod, представленным как иммуномодулирующий препарат S1P. В августе 2015 года Receptos была приобретена Celgene за 7,2 миллиарда долларов за счет наличных средств и нового долга, что привело к увеличению их стоимости акций на 22%. Receptos, Inc. (Celgene) запатентовала синтез озанимода в июле 2016 года. С расширением профиля Celgene в области воспаления и иммунологии компания ожидала, что годовой объем продаж от ozanimod составит от 4 до 6 миллиардов долларов; однако FDA отклонило его заявку на одобрение препарата в феврале 2018 года. Celgene повторно подала заявку в марте 2019 года. Как новый владелец, Bristol Myers Squibb получила одобрение FDA 26 марта 2020 года на пероральные капсулы озанимода (Zeposia) для лечения взрослых с рецидивом формы рассеянного склероза (РС), включая ремиттирующий РС (РРС), активный вторично-прогрессирующий РС (ВПРС) и клинически изолированный синдром (CIS). Озанимод был одобрен для медицинского применения в Европейском Союзе в мае 2020 года и в Австралии в июле 2020 года.
Исследовать
Озанимод находится в разработке для лечения дополнительных иммуновоспалительных показаний, включая язвенный колит и болезнь Крона.
Рекомендации
Внешние ссылки
- «Озанимод» . Информационный портал о наркотиках . Национальная медицинская библиотека США.
- «Озанимода гидрохлорид» . Информационный портал о наркотиках . Национальная медицинская библиотека США.
- Номер клинического испытания NCT02047734 "Исследование эффективности и безопасности озанимода при рецидивирующем рассеянном склерозе (RADIANCE)" на сайте ClinicalTrials.gov.
- Номер клинического испытания NCT02435992 " Исследование безопасности и эффективности RPC1063 при умеренном и тяжелом язвенном колите" на сайте ClinicalTrials.gov.
