Фосфатаза легкой цепи миозина - Myosin-light-chain phosphatase
| Фосфатаза легкой цепи миозина | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Структура комплекса между PP1 и частью MYPT1, генерируемая из 1s70
| |||||||||
| Идентификаторы | |||||||||
| ЕС нет. | 3.1.3.53 | ||||||||
| № CAS | 86417-96-1 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | Amigo / QuickGO | ||||||||
| |||||||||
Фосфатаза легкой цепи миозина , более часто называемая миозинфосфатазой ( EC 3.1.3.53 ), представляет собой фермент (в частности, серин / треонин-специфичную протеинфосфатазу ), который дефосфорилирует регуляторную легкую цепь миозина II . Эта реакция дефосфорилирования происходит в гладкой мышечной ткани и запускает процесс расслабления мышечных клеток. Таким образом, миозинфосфатаза отменяет процесс сокращения мышц, инициированный киназой легких цепей миозина . Фермент состоит из трех субъединиц: каталитической области ( протеинфосфатаза 1 или PP1), субъединицы связывания миозина (MYPT1) и третьей субъединицы (M20) неизвестной функции. Каталитическая область использует два иона марганца в качестве катализаторов для дефосфорилирования легких цепей миозина, что вызывает конформационные изменения миозина и расслабляет мышцы. Фермент очень консервативен и содержится в гладкой мышечной ткани всех организмов. Хотя известно, что миозинфосфатаза регулируется rho-ассоциированными протеинкиназами , в настоящее время ведутся споры о том , регулируют ли фермент также другие молекулы, такие как арахидоновая кислота и цАМФ .
Функция
Гладкая мышечная ткань в основном состоит из актина и миозина, двух белков, которые взаимодействуют друг с другом, чтобы вызвать сокращение и расслабление мышц. Миозин II, также известный как обычный миозин, имеет две тяжелые цепи, которые состоят из головного и хвостового доменов, и четыре легких цепи (по две на голову), которые связываются с тяжелыми цепями в области «шеи». Когда мышце необходимо сокращаться, ионы кальция поступают в цитозоль из саркоплазматической сети , где они активируют кальмодулин, который, в свою очередь, активирует киназу легкой цепи миозина (киназу MLC). Киназа MLC фосфорилирует легкую цепь миозина (MLC 20 ) по остатку Ser-19. Это фосфорилирование вызывает конформационные изменения миозина, активируя циклический переход между мостами и заставляя мышцы сокращаться. Поскольку миозин претерпевает конформационные изменения, мышца будет продолжать сокращаться, даже если концентрации кальция и активированной киназы MLC доведены до нормального уровня. Конформационные изменения должны быть отменены, чтобы расслабить мышцу.
Когда миозинфосфатаза связывается с миозином, она удаляет фосфатную группу . Без группы миозин возвращается к своей исходной конформации, в которой он не может взаимодействовать с актином и удерживать мышцы в напряжении, поэтому мышца расслабляется. Мышца будет оставаться в этом расслабленном положении до тех пор, пока миозин не будет фосфорилирован киназой MLC и не претерпит конформационных изменений.
Состав
Миозинфосфатаза состоит из трех субъединиц. Каталитическая субъединица, PP1, является одной из наиболее важных Ser / Thr фосфатаз в эукариотических клетках , поскольку она играет роль в метаболизме гликогена , внутриклеточном транспорте, синтезе белка и делении клеток, а также в сокращении гладких мышц. Поскольку он так важен для основных клеточных функций и поскольку в клетках гораздо меньше протеинфосфатаз, чем киназ, структура и функция PP1 очень консервативны (хотя специфической изоформой, используемой в миозинфосфатазе, является δ-изоформа, PP1δ). PP1 работает, используя два иона марганца в качестве катализаторов дефосфорилирования (см. Ниже).
Эти ионы окружают Y-образную щель с тремя бороздками: гидрофобной, кислой и С-концевой. Когда PP1 не связан с какой-либо другой субъединицей, это не особенно специфично. Однако, когда он связывается со второй субъединицей миозинфосфатазы, MYPT1 (MW ~ 130 кДа), эта каталитическая щель меняет конфигурацию. Это приводит к резкому увеличению специфичности миозина. Таким образом, очевидно, что MYPT1 обладает большой регулирующей способностью по отношению к PP1 и миозинфосфатазе, даже без присутствия других активаторов или ингибиторов.
Третья субъединица, M20 (не путать с MLC 20 , критической регуляторной субъединицей миозина), является самой маленькой и самой загадочной субъединицей. В настоящее время мало что известно о M20, за исключением того, что он не является необходимым для катализа, поскольку удаление субъединицы не влияет на оборот или селективность. Некоторые считают, что он может выполнять регулирующую функцию, но пока ничего не определено.
Механизм
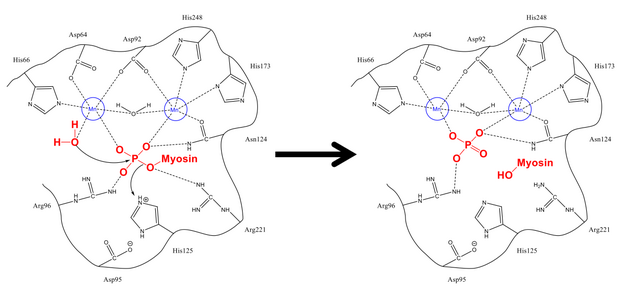
Механизм удаления фосфата из Ser-19 очень похож на другие реакции дефосфорилирования в клетке, такие как активация гликогенсинтазы . Регуляторная субъединица миозина MLC 20 связывается как с гидрофобными, так и с кислотными бороздками PP1 и MYPT1, регуляторного сайта на миозинфосфатазе. Находясь в правильной конфигурации, как фиосфорилированный серин, так и свободная молекула воды стабилизируются остатками, связывающими водородные связи в активном центре, а также положительно заряженными ионами (которые сильно взаимодействуют с отрицательной фосфатной группой). His-125 (на миозинфосфатазе) отдает протон Ser-19 (MLC 20 ), и молекула воды атакует атом фосфора . После перетасовки протонов для стабилизации (что происходит быстро по сравнению с атакой на фосфор) образуются фосфат и спирт, и оба покидают активный центр.
Регулирование и здоровье человека
Пути регуляции MLC-киназы были хорошо изучены, но до конца 1980-х предполагалось, что миозинфосфатаза не регулируется, а сокращение / расслабление полностью зависит от активности MLC-киназы. Однако с 1980-х годов был обнаружен и тщательно исследован ингибирующий эффект rho-ассоциированной протеинкиназы. RhoA GTP активирует Rho-киназу , которая фосфорилирует MYPT1 по двум основным сайтам ингибирования, Thr-696 и Thr-866. Это полностью демонстрирует ценность MYPT1 не только в увеличении скорости и специфичности реакции, но и в значительном замедлении реакции. Однако, когда добавляется телокин , он эффективно отменяет действие Rho-киназы, даже если он не дефосфорилирует MYPT1.
Еще одна предлагаемая стратегия регулирования связана с арахидоновой кислотой. Когда арахидоновая кислота добавляется к напряженной мышечной ткани, кислота снижает скорость дефосфорилирования (и, следовательно, релаксации) миозина. Однако неясно, как арахидоновая кислота действует как ингибитор . Две конкурирующие теории состоят в том, что либо арахидоновая кислота действует как сопутствующий посредник в каскаде ро-киназ, упомянутом выше, либо она связывается с c-концом MYPT1.
Когда системы регуляции миозинфосфатазы начинают давать сбои, это может иметь серьезные последствия для здоровья. Поскольку гладкие мышцы находятся в дыхательной, кровеносной и репродуктивной системах человека (а также в других местах), если гладкие мышцы больше не могут расслабляться из-за неправильной регуляции, тогда возникает широкий круг проблем, начиная от астмы , гипертонии и может возникнуть эректильная дисфункция .
Смотрите также
использованная литература
дальнейшее чтение
- Пато, доктор медицины, Адельштейн Р.С. (1983). «Очистка и характеристика мультисубъединичной фосфатазы из гладких мышц желудка индейки. Влияние связывания кальмодулина с киназой легкой цепи миозина на дефосфорилирование» . J. Biol. Chem . 258 (11): 7047–54. DOI : 10.1016 / S0021-9258 (18) 32330-5 . PMID 6304072 .
- Kimura K; и другие. (1996). «Регулирование миозинфосфатазы с помощью Rho и Rho-ассоциированной киназы (Rho-киназы)». Наука . 273 (5272): 245–248. Bibcode : 1996Sci ... 273..245K . DOI : 10.1126 / science.273.5272.245 . PMID 8662509 . S2CID 37249779 .