Метионин - Methionine

Скелетная формула канонической формы метионина
|
|||
|
|
|||
| Имена | |||
|---|---|---|---|
|
Название ИЮПАК
Метионин
|
|||
| Другие имена
2-амино-4- (метилтио) бутановая кислота
|
|||
| Идентификаторы | |||
|
3D модель ( JSmol )
|
|||
| Сокращения | Met, M | ||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard |
100.000.393 |
||
| Номер ЕС | |||
| КЕГГ | |||
|
PubChem CID
|
|||
| UNII | |||
|
Панель управления CompTox ( EPA )
|
|||
|
|||
|
|||
| Характеристики | |||
| C 5 H 11 N O 2 S | |||
| Молярная масса | 149,21 г · моль -1 | ||
| Появление | Белый кристаллический порошок | ||
| Плотность | 1,340 г / см 3 | ||
| Температура плавления | 281 ° С (538 ° F, 554 К) разлагается | ||
| Растворимый | |||
| Кислотность (p K a ) | 2,28 (карбоксил), 9,21 (амино) | ||
| Фармакология | |||
| V03AB26 ( ВОЗ ) QA05BA90 ( ВОЗ ), QG04BA90 ( ВОЗ ) | |||
| Страница дополнительных данных | |||
|
Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. |
|||
|
Термодинамические
данные |
Фазовое поведение твердое тело – жидкость – газ |
||
| УФ , ИК , ЯМР , МС | |||
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|||
|
|
|||
| Ссылки на инфобоксы | |||
Метионин (символ Мет или М ) ( / м ɪ & thetas ; aɪ ə п я н / ) является незаменимой аминокислотой в организме человека. В качестве субстрата для других аминокислот, таких как цистеин и таурин , универсальных соединений, таких как SAM-e , и важного антиоксиданта глутатиона , метионин играет решающую роль в метаболизме и здоровье многих видов, включая человека. Он кодируется с помощью кодона AUG.
Метионин также является важной частью ангиогенеза , роста новых кровеносных сосудов. Добавка может принести пользу тем, кто страдает от отравления медью. Чрезмерное потребление метионина, донора метильной группы при метилировании ДНК , связано с ростом рака в ряде исследований. Метионин был впервые выделен в 1921 году Джоном Ховардом Мюллером .
Биохимические детали
Метионин (сокращенно Met или M ; кодируется кодоном AUG) представляет собой α- аминокислота , которая используется в биосинтезе из белков . Он содержит α-аминогруппу (которая находится в протонированной форме -NH 3 + в биологических условиях), карбоксильную группу (которая находится в депротонированной форме -COO - в биологических условиях) и боковую цепь S- метилтиоэфира , классификации его в качестве неполярной , алифатической аминокислоты.
В ядерных генов эукариот и в Archaea , метионин кодируется с помощью стартового кодона , а это означает , что указывает на начало кодирующей области и является первой аминокислоты , получают в зарождающейся полипептида во время мРНК перевода .
Протеиногенная аминокислота
Вместе с цистеин , метионин является одним из двух серы отработанных протеиногенных аминокислот . За исключением нескольких исключений, когда метионин может действовать как окислительно-восстановительный датчик (например,), остатки метионина не играют каталитической роли. Это контрастирует с остатками цистеина, где тиоловая группа играет каталитическую роль во многих белках. Однако тиоэфир играет второстепенную структурную роль из-за эффекта стабильности S / π-взаимодействий между атомом серы боковой цепи и ароматическими аминокислотами в одной трети всех известных белковых структур. Это отсутствие сильной роли отражено в экспериментах, в которых наблюдается небольшой эффект у белков, в которых метионин заменен норлейцином , аминокислотой с прямой углеводородной боковой цепью, в которой отсутствует тиоэфир. Было высказано предположение, что норлейцин присутствовал в ранних версиях генетического кода, но метионин вторгся в окончательную версию генетического кода из-за того, что он используется в кофакторе S -аденозилметионина (SAM-e). Эта ситуация не уникальна и могла произойти с орнитином и аргинином.
Кодирование
Метионин - одна из двух аминокислот, кодируемых одним кодоном (AUG) в стандартном генетическом коде ( другой - триптофан , кодируемый UGG). Отражая эволюционное происхождение его кодона, другие кодоны AUN кодируют изолейцин, который также является гидрофобной аминокислотой. В митохондриальном геноме нескольких организмов, включая метазоа и дрожжи , кодон AUA также кодирует метионин. В стандартном генетическом коде AUA кодирует изолейцин, а соответствующая тРНК ( ileX в Escherichia coli ) использует необычное основание лизидин (бактерии) или агматидин (археи) для дискриминации AUG.
Кодон метионина AUG также является наиболее распространенным стартовым кодоном. «Стартовый» кодон - это сообщение для рибосомы, которое сигнализирует об инициации трансляции белка с мРНК, когда кодон AUG находится в консенсусной последовательности Козака . Как следствие, метионин часто включается в N-концевое положение белков у эукариот и архей во время трансляции, хотя он может быть удален с помощью посттрансляционной модификации . В бактериях в качестве исходной аминокислоты используется производное N- формилметионина .
Производные
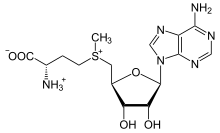
S- аденозил-метионин
Производное метионина S- аденозилметионин (SAM-e) является кофактором, который служит главным образом донором метила . SAM-e состоит из молекулы аденозила (через 5 'углерод), присоединенной к сере метионина, что делает его катионом сульфония (т. Е. Тремя заместителями и положительным зарядом). Сера действует как мягкая кислота Льюиса (то есть донор / электрофил), которая позволяет S- метильной группе переноситься в кислород, азот или ароматическую систему, часто с помощью других кофакторов, таких как кобаламин (витамин B12 в организме человека). ). Некоторые ферменты используют SAM-e для инициирования радикальной реакции; они называются радикальными SAM- ферментами. В результате переноса метильной группы получается S-аденозил-гомоцистеин. У бактерий он либо регенерируется путем метилирования, либо спасается путем удаления аденина и гомоцистеина, в результате чего соединение дигидроксипентандион спонтанно превращается в аутоиндуктор-2 , который выводится как ненужный продукт / сигнал кворума.
Биосинтез
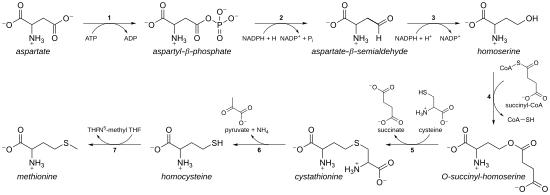
Как незаменимая аминокислота, метионин не синтезируется de novo у людей и других животных, которые должны принимать метионин или метионинсодержащие белки. У растений и микроорганизмов биосинтез метионина принадлежит к семейству аспартатов , наряду с треонином и лизином (через диаминопимелат , но не через α-аминоадипат ). Основная цепь образуется из аспарагиновой кислоты , а сера может происходить из цистеина , метантиола или сероводорода .
- Во-первых, аспарагиновая кислота превращается через β-аспартил-полуальдегид в гомосерин в результате двух стадий восстановления концевой карбоксильной группы (гомосерин, следовательно, имеет γ-гидроксил, следовательно, гомосерин ). Промежуточный аспартат-полуальдегид является точкой разветвления пути биосинтеза лизина, где он вместо этого конденсируется с пируватом. Гомосерин является точкой разветвления треонинового пути, где вместо этого он изомеризуется после активации концевого гидроксила фосфатом (также используется для биосинтеза метионина в растениях).
- Затем гомосерин активируется фосфатной, сукцинильной или ацетильной группой гидроксила.
- В растениях и, возможно, в некоторых бактериях используется фосфат. Этот шаг используется совместно с биосинтезом треонина.
- У большинства организмов ацетильная группа используется для активации гомосерина. В бактериях это может катализироваться ферментом, кодируемым metX или metA (не гомологами).
- У энтеробактерий и ограниченного числа других организмов используется сукцинат. Фермент, который катализирует реакцию, - это MetA, а специфичность к ацетил-КоА и сукцинил-КоА определяется одним остатком. Физиологическая основа предпочтения ацетил-КоА или сукцинил-КоА неизвестна, но такие альтернативные пути присутствуют в некоторых других путях ( например, биосинтез лизина и биосинтез аргинина).
- Затем активирующую гидроксил группу заменяют цистеином, метантиолом или сероводородом. Реакция замещения технически представляет собой γ- отщепление с последующим вариантом присоединения по Михаэлю . Все задействованные ферменты являются гомологами и членами семейства PLP-зависимых ферментов метаболизма Cys / Met , которое является подмножеством PLP-зависимой складчатой клады типа I. Они используют кофактор PLP ( пиридоксальфосфат ), который стабилизирует карбанионные промежуточные соединения.
- Если он реагирует с цистеином, он производит цистатионин , который расщепляется с образованием гомоцистеина . Участвующие ферменты представляют собой цистатионин-γ-синтазу (кодируемую metB в бактериях) и цистатионин-β-лиазу ( metC ). Цистатионин по-разному связывается двумя ферментами, позволяя протекать β- или γ-реакциям.
- Если он реагирует со свободным сероводородом, он производит гомоцистеин. Это катализируется O- ацетилгомосерин-аминокарбоксипропилтрансферазой (ранее известной как O- ацетилгомосерин (тиол) -лиаза. У бактерий она кодируется metY или metZ .
- Если он вступает в реакцию с метантиолом, он производит непосредственно метионин. Метантиол является побочным продуктом катаболического пути некоторых соединений, поэтому этот путь более редок.
- Если гомоцистеин продуцируется, тиоловая группа метилируется, давая метионин. Известны две метионинсинтазы ; один зависит от кобаламина (витамин B 12 ), а другой - от независимого.
Путь с использованием цистеина называется « путем транссульфурации », а путь с использованием сероводорода (или метантиола) называется «путем прямого сульфурирования».
Цистеин продуцируется аналогичным образом, а именно, он может быть получен из активированного серина и либо из гомоцистеина («путь обратного транс-сульфурирования»), либо из сероводорода («путь прямого сульфурирования»); активированный серин обычно представляет собой O- ацетил-серин (через CysK или CysM в E. coli ), но в Aeropyrum pernix и некоторых других архях используется O- фосфосерин. CysK и CysM являются гомологами, но принадлежат к кладе типа III складки PLP.
Путь транс-сульфулирования
Ферменты, участвующие в пути транс-сульфурирования E. coli биосинтеза метионина:
- Аспартокиназа
- Аспартат-полуальдегиддегидрогеназа
- Гомосериндегидрогеназа
- Гомосерин-О-транссукцинилаза
- Цистатионин-γ-синтаза
- Цистатионин-β-лиаза
- Метионинсинтаза (у млекопитающих эту стадию выполняет гомоцистеинметилтрансфераза или бетаин-гомоцистеин-S-метилтрансфераза ).
Другие биохимические пути
Хотя млекопитающие не могут синтезировать метионин, они все же могут использовать его в различных биохимических путях:
Катаболизм
Метионин превращается в S-аденозилметионин (SAM-e) с помощью (1) метионин-аденозилтрансферазы .
SAM-e служит донором метила во многих (2) реакциях метилтрансферазы и превращается в S- аденозилгомоцистеин (SAH).
(3) Цистеин аденозилгомоцистеиназы .
Регенерация
Метионин можно регенерировать из гомоцистеина через (4) метионинсинтазу в реакции, которая требует витамина B 12 в качестве кофактора .
Гомоцистеин также можно реметилировать с использованием глицин-бетаина (NNN-триметилглицин, TMG) до метионина с помощью фермента бетаин-гомоцистеинметилтрансферазы (EC2.1.1.5, BHMT). BHMT составляет до 1,5% от всего растворимого белка печени, и недавние данные свидетельствуют о том, что он может иметь большее влияние на гомеостаз метионина и гомоцистеина, чем метионинсинтаза.
Путь обратного трансульфурилирования: превращение в цистеин
Гомоцистеин можно превратить в цистеин.
- (5) Цистатионин-β-синтаза (фермент, который требует активной формы витамина B6 , пиридоксальфосфата ) объединяет гомоцистеин и серин для производства цистатионина . Вместо разложения цистатионина посредством цистатионин-β-лиазы , как в пути биосинтеза, цистатионин расщепляется на цистеин и α-кетобутират через (6) цистатионин-γ-лиазу .
- (7) Фермент α-кетокислота дегидрогеназа превращает α-кетобутират в пропионил-КоА , который метаболизируется до сукцинил-КоА в трехступенчатом процессе (см. Пропионил-КоА ).
Синтез этилена
Эта аминокислота также используется растениями для синтеза этилена . Этот процесс известен как цикл Ян или цикл метионина.
Химический синтез
Промышленный синтез объединяет акролеин , метантиол и цианид, что дает гидантоин . Рацемический метионин также можно синтезировать из фталимидомалоната диэтилнатрия путем алкилирования хлорэтилметилсульфидом (ClCH 2 CH 2 SCH 3 ) с последующим гидролизом и декарбоксилированием.
Питание человека
Требования
Совет по пищевым продуктам и питанию Института медицины США установил Рекомендуемые диетические нормы (RDA) для незаменимых аминокислот в 2002 году. Для метионина в сочетании с цистеином для взрослых от 19 лет и старше - 19 мг / кг массы тела / день.
Это составляет около 1,33 грамма в день для человека весом 70 кг.
Диетические источники
| Еда | г / 100г |
|---|---|
| Яйцо , белок, сушеное, порошковое, с пониженным содержанием глюкозы | 3,204 |
| Мука из семян кунжута (обезжиренная) | 1,656 |
| бразильский орех | 1,124 |
| Сыр , Пармезан, тертый | 1,114 |
| семена конопли , лущеные | 0,933 |
| Концентрат соевого белка | 0,814 |
| Курица , бройлеры или фритюрницы, жареные | 0,801 |
| Рыба , тунец, светлая, консервированная в воде, сушеные твердые вещества | 0,755 |
| Говядина вяленая, сушеная | 0,749 |
| Бекон | 0,593 |
| Семена чиа | 0,588 |
| Говядина , фарш, 95% нежирного мяса / 5% жира, сырая | 0,565 |
| Свинина , фарш, 96% постная / 4% жирная, сырая | 0,564 |
| Соевые бобы | 0,547 |
| Зародыши пшеницы | 0,456 |
| Яйцо , целое, вареное, сваренное вкрутую | 0,392 |
| Овсяный | 0,312 |
| Арахис | 0,309 |
| Нута | 0,253 |
| Кукуруза , желтая | 0,197 |
| Миндаль | 0,151 |
| Фасоль, пинто, приготовленная | 0,117 |
| Чечевица , приготовленная | 0,077 |
| Рис коричневый, среднезернистый, вареный | 0,052 |
Высокий уровень метионина содержится в яйцах, мясе и рыбе; семена кунжута, бразильские орехи и некоторые другие семена растений; и зерновые злаки. Большинство фруктов и овощей содержат очень мало. Большинство бобовых , хотя и богаты белком, содержат мало метионина. Белки без адекватного количества метионина не считаются полноценными белками . По этой причине рацемический метионин иногда добавляют в качестве ингредиента в корма для домашних животных .
Ограничение
Некоторые научные данные показывают, что ограничение потребления метионина может увеличить продолжительность жизни плодовых мух.
Исследование 2005 года показало, что ограничение метионина без ограничения энергии увеличивает продолжительность жизни мышей. Это удлинение требует интактной передачи сигналов гормона роста, поскольку животные без интактной передачи сигналов гормона роста не имеют дальнейшего увеличения продолжительности жизни при ограничении метионина. Метаболический ответ на ограничение метионина также изменяется у сигнальных мутантов гормона роста мышей.
Исследование, опубликованное в Nature, показало, что добавление только незаменимой аминокислоты метионина в рацион плодовых мушек при диетических ограничениях, включая ограничение незаменимых аминокислот (EAA), восстанавливает фертильность без сокращения продолжительности жизни, типичной для диетических ограничений, что привело исследователей для определения того, что метионин «действует в сочетании с одним или несколькими другими EAA, сокращая продолжительность жизни». Восстановление метионина в рационе мышей, соблюдающих режим ограничения диеты, блокирует многие преимущества ограничения диеты, процесс, который может быть опосредован увеличением производства сероводорода.
Несколько исследований показали, что ограничение метионина также подавляет связанные со старением болезненные процессы у мышей и подавляет канцерогенез толстой кишки у крыс. У людей ограничение метионина путем модификации диеты может быть достигнуто с помощью растительной диеты.
Ограничение диетического метионина снижает уровни его катаболита S-аденозилметионина (SAM-e), что приводит к последующей потере метилирования гистонов . Активный процесс, опосредованный специфическим сохраненным метилированием H3K9, сохраняет память об исходном профиле метилирования, позволяя восстанавливать эпигеном во время приема пищи, когда уровни метионина возвращаются.
Исследование на крысах, проведенное в 2009 году, показало, что «добавление метионина в рацион специально увеличивает выработку митохондриальных АФК и окислительное повреждение митохондриальной ДНК в митохондриях печени крысы, предлагая вероятный механизм его гепатотоксичности ».
Однако, поскольку метионин является незаменимой аминокислотой , его нельзя полностью удалить из рациона животных без болезни или смерти со временем. Например, у крыс, получавших диету без метионина и холина, развился стеатогепатит (ожирение печени) и анемия , и они потеряли две трети своего веса за 5 недель. Прием метионина улучшил патологические последствия метиониновой депривации. Кратковременное исключение из рациона только метионина может обратить вспять вызванное диетой ожирение и повысить чувствительность к инсулину у мышей, а ограничение метионина также защищает мышиную модель спонтанного полигенного ожирения и диабета.
Здоровье
Потеря метионина связана с старческим поседением волос. Его недостаток приводит к накоплению перекиси водорода в волосяных фолликулах, снижению эффективности тирозиназы и постепенной потере цвета волос. Метионин повышает внутриклеточную концентрацию GSH, тем самым способствуя антиоксидантной защите клеток и окислительно-восстановительной регуляции. Он также защищает клетки от потери нигральных клеток, вызванной допамином, путем связывания окислительных метаболитов.
Метионин является промежуточным звеном в биосинтезе цистеина , карнитина , таурина , лецитина , фосфатидилхолина и других фосфолипидов . Неправильное преобразование метионина может привести к атеросклерозу из-за накопления гомоцистеина .
Другое использование
DL- метионин иногда назначают собакам в качестве добавки; Это помогает снизить вероятность образования камней в почках у собак. Также известно, что метионин увеличивает выведение хинидина с мочой за счет подкисления мочи. Аминогликозидные антибиотики, используемые для лечения инфекций мочевыводящих путей, лучше всего работают в щелочных условиях, а закисление мочи при использовании метионина может снизить его эффективность. Если собака сидит на диете, которая подкисляет мочу, не следует использовать метионин.
Метионин разрешен в качестве добавки к органическому корму для птицы в рамках сертифицированной органической программы США.
Метионин можно использовать в качестве нетоксичного пестицида против гигантских гусениц ласточкиного хвоста , которые являются серьезным вредителем апельсиновых культур.
Смотрите также
- Аллантоин
- Формилметионин
- Окисление метионина
- Отравление парацетамолом
- Фотореактивный метионин
- S-метилцистеин
использованная литература
внешние ссылки
- Рудра М.Н., Чоудхури Л.М. (30 сентября 1950 г.). «Содержание метионина в зерновых и бобовых культурах» . Природа . 166 (568): 568. Bibcode : 1950Natur.166..568R . DOI : 10.1038 / 166568a0 . PMID 14780151 . S2CID 3026278 .