Металлотионеин - Metallothionein
| Надсемейство металлотионеинов (растение) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||
| Идентификаторы | |||||||||||
| Условное обозначение | Металлотионеин_сфам | ||||||||||
| Pfam | PF00131 | ||||||||||
| ИнтерПро | IPR003019 | ||||||||||
| |||||||||||
| Дрожжи МТ | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Металлотионеин MT Saccharomyces cerevisiae связывается с ионами меди . Цистеины в желтом, медь в коричневом. ( PDB : 1AQS )
| |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Дрожжевой металлотионеин | ||||||||
| Pfam | PF11403 | ||||||||
| Клан пфам | CL0461 | ||||||||
| ИнтерПро | IPR022710 | ||||||||
| |||||||||
| Цианобактерии SmtA | |||||||||
|---|---|---|---|---|---|---|---|---|---|
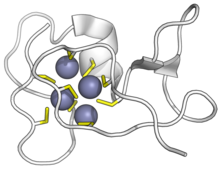
Цианобактериальный металлотионеин SmtA связывается с ионами цинка. Цистеины желтого цвета, цинка фиолетового цвета. ( PDB : 1JJD )
| |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Бактериальный металлотионеин | ||||||||
| Pfam | PF02069 | ||||||||
| Клан пфам | CL0461 | ||||||||
| ИнтерПро | IPR000518 | ||||||||
| |||||||||
Металлотионеин (МТ) представляет собой семейство цистеина -Rich, низкой молекулярной массой (MW в интервале от 500 до 14000 Da ) белков . Они локализуются на мембране аппарата Гольджи . МТ обладают способностью связывать как физиологические (такие как цинк , медь , селен ), так и ксенобиотические (такие как кадмий , ртуть , серебро , мышьяк ) тяжелые металлы через тиольную группу его цистеиновых остатков, которые составляют почти 30% составляющих его аминокислот. кислотные остатки.
МТ был открыт в 1957 году Валле и Маргоше при очистке Cd-связывающего белка коры почек лошади (лошади) . МТ играет роль в защите от токсичности металлов и окислительного стресса , а также участвует в регуляции цинка и меди. У человека экспрессируются четыре основные изоформы (семья 1, см. Диаграмму ниже): MT1 (подтипы A , B , E , F , G , H , L , M , X ), MT2 , MT3 и MT4 . В организме человека большие количества синтезируются, прежде всего, в печени и почках . Их производство зависит от наличия пищевых минералов, таких как цинк , медь и селен , а также аминокислот гистидина и цистеина.
Металлотионеины богаты тиолами, что позволяет им связывать ряд следов металлов. Металлотионеин связывает несколько ионов Zn. Один из немногих эукариотических белков, который, как известно, играет важную роль в детоксикации металлов. Цинк и кадмий тетраэдрически координированы с остатками цистеина, каждая молекула белка металлотионеина может связывать до 7 атомов Zn или Cd. Биосинтез металлотионеина, по-видимому, увеличился в несколько раз на протяжении всего окислительного стресса, чтобы защитить клетки от цитотоксичности и повреждения ДНК. Биосинтез металлотионеина также может быть вызван определенными агентами или условиями, например гормонами, фармацевтическими препаратами, спиртами, другими веществами для лечения и многими другими. Металлотионеин - цитоплазматический белок, у взрослого человека он локализуется преимущественно в цитоплазме. У плода человека металлотионеин локализуется в ядрах гепатоцитов.
Структура и классификация
МТ присутствуют в широком диапазоне таксономических групп, начиная от прокариот (таких как цианобактерии Synechococcus sp. ), Простейших (таких как инфузории рода Tetrahymena ), растений (таких как Pisum sativum , Triticum durum , Zea mays или Quercus suber). ), дрожжи (например, Saccharomyces CEREVISIAE или Candida Albicans ), беспозвоночные (такие как нематоды Caenorhabditis Элеганс , насекомое дрозофилы , моллюск Mytilus гриб , или иглокожих пурпурный стронгилоцентротус ) и позвоночных животных (таких , как курица Gallus Gallus , или млекопитающее Homo sapiens или Mus musculus ).
MT из этого разнообразного таксономического диапазона представляют собой последовательность с высокой гетерогенностью (в отношении молекулярной массы, числа и распределения остатков Cys) и не проявляют общей гомологии; Несмотря на это, гомология обнаруживается внутри некоторых таксономических групп (например, МТ позвоночных).
По своей первичной структуре МТ были классифицированы разными методами. Первый датируется 1987 годом, когда Fowler et al. , установили три класса МТ: Класс I, включая МТ, которые демонстрируют гомологию с МТ лошади, Класс II, включая остальные МТ, не гомологичные с МТ лошади, и Класс III, который включает фитохелатины , богатые Cys ферментативно синтезированные пептиды. . Вторая классификация была проведена Бинцем и Каги в 2001 году и учитывает таксономические параметры и закономерности распределения остатков Cys вдоль последовательности MT. Это приводит к классификации 15 семейств белковых МТ. Семейство 15 содержит растительные МТ, которые в 2002 г. были дополнительно классифицированы Коббетом и Голдсбро на 4 типа (1, 2, 3 и 4) в зависимости от распределения их остатков Cys и участков, лишенных Cys (называемых спейсерами), характерных для завод МЦ.
Приведена таблица, включающая основные аспекты двух последних классификаций.
| Семья | Имя | Образец последовательности | Пример |
|---|---|---|---|
| 1 | Позвоночное животное | Кх (1,2) -CCxCCPx (2) -C |
Mus musculus MT1 MDPNCSCTTGGSCACAGSCKCKECKCTSCKKCCSCCPVGCAKCAQGCVCKGSSEKCRCCA |
| 2 | Моллюск | CxCx (3) -CTGx (3) -CxCx (3) -CxCK |
Mytilus edulis 10MTIV MPAPCNCIETNVCICDTGCSGEGCRCGDACKCSGADCKCSGCKVVCKCSGSCACEGGCTGPSTCKCAPGCSCK |
| 3 | Ракообразный | P- [GD] -PCCx (3,4) -CxC |
Homarus americanus MTH MPGPCCKDKCECAEGGCKTGCKCTSCRCAPCEKCTSGCKCPSKDECAKTCSKPCKCCP |
| 4 | Иглокожие | PDxKCVCCx (5) -CxCx (4) -CCx (4) -CCx (4,6) -CC |
Strongylocentrotus purpuratus SpMTA MPDVKCVCCKEGKECACFGQDCCKTGECCKDGTCCGICTNAACKCANGCKCGSGCSCTEGNCAC |
| 5 | Двукрылые | CGx (2) -CxCx (2) -Qx (5) -CxCx (2) DCxC |
Drosophila melanogaster MTNB MVCKGCGTNCQCSAQKCGDNCACNKDCQCVCKNGPKDQCCSNK |
| 6 | Нематода | KCCx (3) -CC |
Caenorhabditis elegans MT1 MACKCDCKNKQCKCGDKCECSGDKCCEKYCCEEASEKKCCPAGCKGDCKCANCHCAEQKQCGDKTHQHQGTAAAH |
| 7 | Инфузорий | xCCCx? |
Tetrahymena thermophila MTT1 MDKVNSCCCGVNAKPCCTDPNSGCCCVSKTDNCCKSDTKECCTGTGEGCKCVNCKCCKPQANCCCGVNAKPCCFDPNSGCCCVSKTNNCCNKKSD TKECCTGTGEGCCCGCTS |
| 8 | Грибковый 1 | CGCSx (4) -CxCx (3,4) -CxCSxC |
Neurospora crassa MT MGDCGCSGASSCNCGSGCSCSNCGSK |
| 9 | Грибок 2 | --- |
Candida glabrata MT2 MANDCKCPNGCSCPNCANGGCQCGDKCECKKQSCHGCGEQCKCGSHGSSCHGSCGCGDKCECK |
| 10 | Грибковый 3 | --- |
Candida glabrata MT2 MPEQVNCQYDCHCSNCACENTCNCCAKPACACTNSASNECSCQTCKCQTCKC |
| 11 | Грибковый 4 | CXKCxCx (2) -CKC |
Yarrowia lipolytica MT3 MEFTTAMLGASLISTTSTQSKHNLVNNCCCSSSTSESSMPASCACTKCGCKTCKC |
| 12 | Грибковый 5 | --- |
Saccharomyces cerevisiae CUP1 MFSELINFQNEGHECQCQCGSCKNNEQCQKSCSCPTGCNSDDKCPCGNKSEETKKSCCSGK |
| 13 | Грибковый 6 | --- |
Saccharomyces cerevisiae CRS5 TVKICDCEGECCKDSCHCGSTCLPSCSGGEKCKCDHSTGSPQCKSCGEKCKCETTCTCEKSKCNCEKC |
| 14 | Прокариота | KCACx (2) -CLC |
Synechococcus sp SmtA MTTVTQMKCACPHCLCIVSLNDAIMVDGKPYCSEVCANGTCKENSGCGHAGCGCGSA |
| 15 | Растение | [YFH] -x (5,25) -C- [SKD] -C- [GA] - [SDPAT] -x (0,1) -Cx- [CYF] | |
| 15.1 | Завод МЦ Тип 1 | CXCX (3) - CXCX (3) - CXCX (3) -спейсер-CXCX (3) - CXCX (3) - CXCX (3) |
Pisum sativum MT MSGCGCGSSCNCGDSCKCNKRSSGLSYSEMETTETVILGVGPAKIQFEGAEMSAASEDGGCKCGDNCTCDPCNCK |
| 15,2 | Завод МЦ Тип 2 | CCX (3) -CXCX (3) - CXCX (3) - CXCX (3) -спейсер- CXCX (3) - CXCX (3) - CXCX (3) |
Lycopersicon esculentum MT MSCCGGNCGCGSSCKCGNGCGGCKMYPDMSYTESSTTTETLVLGVGPEKTSFGAMEMGESPVAENGCKCGSDCKCNPCTCSK |
| 15.3 | Завод МЦ Тип 3 | --- |
Arabidopsis thaliana MT3 MSSNCGSCDCADKTQCVKKGTSYTFDIVETQESYKEAMIMDVGAEENNANCKCKCGSSCVNCTCCPN |
| 15.4 | Завод МЦ Тип 4 или Ес | Cx (4) -CXCX (3) -CX (5) -CXCX (9,11) -HTTCGCGEHC-
XCX (20) -CSCGAXCNCASC-X (3,5) |
Triticum aestivum MT MGCNDKCGCAVPCPGGTGCRCTSARSDAAAGEHTTCGCGEHCGCNPCACGREGTPSGRANRRANCSCGAACNCASCGSTTA |
| 99 | Фитохелатины и другие небелковые МТ-подобные полипептиды | --- |
Schizosaccharomyces pombe γEC-γEC-γECG |
Дополнительные данные по этой классификации можно найти на странице Expasy metallothionein.
Вторичные элементы структуры наблюдались в нескольких МТ SmtA из Syneccochoccus , МТ3 млекопитающих, Echinoderma SpMTA, МТ рыб Notothenia coriiceps , МТН ракообразных, но до этого момента содержание таких структур в МТ считается низким, и его функциональное влияние снижается. не рассматривается.
Третичная структура МП также весьма неоднородна. В то время как МТ позвоночных, иглокожих и ракообразных демонстрируют бидоминиальную структуру с двухвалентными металлами, такими как Zn (II) или Cd (II) (белок свернут так, чтобы связывать металлы в двух функционально независимых доменах, каждый с металлическим кластером ), дрожжевой и прокариотический МТ имеют монодоминиальную структуру (один домен с одним металлическим кластером ). Хотя структурных данных для MT моллюсков, нематод и дрозофилы нет, обычно предполагается, что первые являются бидоминиальными, а вторые - монодоминиальными. Окончательных данных по MT растений нет, но были предложены две возможные структуры: 1) бидоминальная структура, аналогичная структуре MT позвоночных; 2) кодоминиальная структура, в которой два богатых Cys домена взаимодействуют с образованием единого металлического кластера.
Четвертичная структура широко не рассматривалась для MT. Процессы димеризации и олигомеризации наблюдались и приписывались нескольким молекулярным механизмам, включая образование межмолекулярных дисульфидов, мостиковое соединение металлов, связанных остатками Cys или His на различных MT, или взаимодействия, опосредованные неорганическими фосфатами. Было показано, что димерные и полимерные МТ приобретают новые свойства при детоксикации металлов, но физиологическое значение этих процессов было продемонстрировано только в случае прокариотического Synechococcus SmtA. Димер МТ, продуцируемый этим организмом, образует структуры, похожие на цинковые пальцы, и обладает Zn-регуляторной активностью.
Металлотионеины обладают разнообразными предпочтениями в связывании металлов, которые связаны с функциональной специфичностью. Например, Mus musculus MT1 млекопитающих предпочтительно связывает ионы двухвалентных металлов (Zn (II), Cd (II), ...), в то время как дрожжевой CUP1 является селективным в отношении ионов одновалентных металлов (Cu (I), Ag (I), ...). Строго металл-селективные МТ с металл-специфическими физиологическими функциями были открыты Dallinger et al. (1997) у легочных улиток (Gastropoda, Mollusca). Римская улитка ( Helix pomatia ), например, обладает Cd-селективной (CdMT) и Cu-селективной изоформой (CuMT), участвующими в детоксикации Cd и регуляции Cu, соответственно. В то время как обе изоформы содержат неизменные числа и положения остатков Cys, ответственных за лигирование металлов, избирательность по металлу, по-видимому, достигается за счет модуляции последовательности аминокислотных остатков, не участвующих непосредственно в связывании металлов (Palacios et al. 2011).
Новая функциональная классификация МТ на Zn- или Cu-тионеины в настоящее время разрабатывается на основе этих функциональных предпочтений.
Дрожжи
Металлотионеины характеризуются обилием остатков цистеина и отсутствием общих мотивов вторичной структуры . Металлотионеин дрожжей (MT) также альтернативно называют металлотионеином меди (CUP). Металлотионеин дрожжей гораздо сильнее координируется с Cu +, чем с Cu 2+ .
Функция
Этот белок участвует в хранении, транспортировке и детоксикации первичных металлов . В частности, Yeast MT хранит медь, поэтому защищает клетку от токсичности меди, плотно связывая ионы меди.
Для первых 40 остатков в белке полипептид оборачивается вокруг металла, образуя две большие параллельные петли, разделенные глубокой щелью, содержащей металлический кластер.
Примеры
Дрожжевой MT можно найти в следующем:
- Saccharomyces cerevisiae
- Neurospora crassa
Функция
Металлический переплет
Было документально подтверждено, что металлотионеин связывает широкий спектр металлов, включая кадмий, свинец, цинк, ртуть, медь, мышьяк, серебро и т. Д. последовательный, некооперативный механизм. Наблюдение за частично металлизированным МТ (то есть имеющим некоторую способность связывать свободный металл) позволяет предположить, что эти виды являются биологически важными.
Металлотионеины, вероятно, участвуют в захвате, транспорте и регуляции цинка в биологических системах. МТ млекопитающих связывает три иона Zn (II) в своем бета-домене и четыре в альфа-домене. Цистеин - серосодержащая аминокислота, отсюда и название «-тионеин». Однако для некоторых форм МТ было предложено участие неорганических сульфид- и хлорид-ионов. В некоторых МТ, в основном бактериальных, гистидин участвует в связывании цинка. Связывая и высвобождая цинк, металлотионеины (MT) могут регулировать уровень цинка в организме. Цинк, в свою очередь, является ключевым элементом для активации и связывания определенных факторов транскрипции благодаря его участию в области цинкового пальца белка. Металлотионеин также переносит ионы цинка (сигналы) из одной части клетки в другую. Когда цинк попадает в клетку, он может быть захвачен тионеином (который, таким образом, становится «металлотионеином») и перенесен в другую часть клетки, где он высвобождается в другую органеллу или белок. Таким образом, тионеин и металлотионеин становятся ключевыми компонентами сигнальной системы цинка в клетках. Эта система особенно важна в головном мозге, где передача сигналов цинка важна как между нервными клетками, так и внутри них. Это также, по-видимому, важно для регуляции белка-супрессора опухолей p53.
Контроль окислительного стресса
Остатки цистеина из MT могут захватывать вредные радикалы окислителя, такие как супероксид и гидроксильные радикалы. В этой реакции цистеин окисляется до цистина , и ионы металлов, которые были связаны с цистеином, высвобождаются в среду. Как объяснено в разделе « Экспрессия и регуляция », этот Zn может активировать синтез большего количества MT. Было высказано предположение, что этот механизм является важным механизмом в контроле окислительного стресса с помощью МТ. Роль MT в снижении окислительного стресса подтверждена мутантами MT Knockout, но некоторые эксперименты предполагают также прооксидантную роль MT.
Металлотионеин также играет роль в дифференцировке и пролиферации гемопоэтических клеток, а также в предотвращении апоптоза ранних дифференцированных клеток. Индуцированные уровни МТ были неблагоприятно связаны с чувствительностью к апоптозу, индуцированному этопозидом, что означает, что МТ является потенциальным негативным регулятором апоптоза.
Выражение и регулирование
Экспрессия гена металлотионеина индуцируется множеством стимулов, таких как воздействие металлов, окислительный стресс, глюкокортикоиды, витамин D , водный стресс, голодание , упражнения и т. Д. Уровень ответа на эти индукторы зависит от гена MT. Гены MT присутствуют в своих промоторах, специфических последовательностях для регуляции экспрессии, такие элементы, как элементы ответа на металл (MRE), элементы ответа на глюкокортикоиды (GRE), GC-богатые блоки, элементы базального уровня (BLE) и элементы ответа щитовидной железы (TRE) .
Металлотионеин и болезнь
Рак
Поскольку MT играют важную роль в регуляции факторов транскрипции, дефекты функции или экспрессии MT могут привести к злокачественной трансформации клеток и, в конечном итоге, к раку . Исследования показали повышенную экспрессию МТ при некоторых формах рака груди, толстой кишки, почек, печени, кожи (меланома), легких, носоглотки, яичников, предстательной железы, рта, слюнной железы, яичек, щитовидной железы и мочевого пузыря; они также обнаружили более низкие уровни экспрессии МТ при гепатоцеллюлярной карциноме и аденокарциноме печени.
Есть данные, позволяющие предположить, что более высокие уровни экспрессии МТ также могут приводить к устойчивости к химиотерапевтическим препаратам.
Аутизм
Токсичность тяжелых металлов была предложена в качестве гипотетического этиологии с аутизмом , и дисфункция синтеза и активности МП может играть определенную роль в этом. Многие тяжелые металлы, включая ртуть , свинец и мышьяк , связаны с симптомами, напоминающими неврологические симптомы аутизма. Однако дисфункция МТ не связана конкретно с расстройствами аутистического спектра. Исследование 2006 года, в котором изучались дети, подвергавшиеся воздействию консерванта тиомерсала в вакцине , показало, что уровни МТ и антител к МТ у аутичных детей существенно не отличались от неаутичных детей.
Низкое соотношение цинка и меди рассматривается как биомаркер аутизма и считается признаком того, что система металлотионеина была затронута.
Кроме того, есть признаки того, что уровень цинка у матери может повлиять на иммунологическое состояние развивающегося ребенка, что может привести к аутизму и может снова быть признаком того, что система металлотионеина была затронута.
Смотрите также
использованная литература
дальнейшее чтение
- Cherian MG, Jayasurya A, Bay BH (декабрь 2003 г.). «Металлотионеины в опухолях человека и потенциальная роль в канцерогенезе». Мутационные исследования . 533 (1–2): 201–9. DOI : 10.1016 / j.mrfmmm.2003.07.013 . PMID 14643421 .
