Половина реакции - Half-reaction
Полуреакции (или реакции Полуэлемент) является либо окисление или восстановление реакционный компонент окислительно - восстановительной реакции. Половина реакции получается путем рассмотрения изменения степени окисления отдельных веществ, участвующих в окислительно-восстановительной реакции. Часто концепция полуреакций используется для описания того, что происходит в электрохимическом элементе , например в гальванической батарее. Половинные реакции могут быть записаны для описания как металла, подвергающегося окислению (известного как анод ), так и металла, подвергающегося восстановлению (известного как катод ).
Половинные реакции часто используются как метод уравновешивания окислительно-восстановительных реакций. Для окислительно-восстановительных реакций в кислых условиях после уравновешивания атомов и степеней окисления необходимо добавить ионы H + , чтобы уравновесить ионы водорода в полуреакции. Для окислительно-восстановительных реакций в основных условиях, после уравновешивания атомов и степеней окисления, сначала относитесь к нему как к кислому раствору, а затем добавляйте ионы OH - для уравновешивания ионов H + в полуреакциях (которые дадут H 2 O).
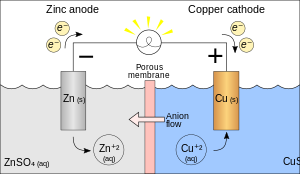
Пример: гальванический элемент Zn и Cu
Рассмотрим гальванический элемент, показанный на изображении рядом: он состоит из кусочка цинка (Zn), погруженного в раствор сульфата цинка (ZnSO 4 ), и кусочка меди (Cu), погруженного в раствор сульфата меди (II). (CuSO 4 ). Общая реакция такова:
- Zn (т.) + CuSO 4 (водн.) → ZnSO 4 (водн.) + Cu (т. Е. )
На аноде из цинка происходит окисление (металл теряет электроны). Это представлено в следующей полуреакции окисления (обратите внимание, что электроны находятся на стороне продуктов):
- Zn (т) → Zn 2+ + 2e -
На катоде Cu происходит восстановление (принимаются электроны). Это представлено в следующей полуреакции восстановления (обратите внимание, что электроны находятся на стороне реагентов):
- Cu 2+ + 2e - → Cu (т)
Пример: окисление магния
Рассмотрим пример обжига магниевой ленты (Mg). Когда магний горит, он соединяется с кислородом (O 2 ) из воздуха с образованием оксида магния (MgO) в соответствии со следующим уравнением:
- 2Mg (тв) + O 2 (г) → 2MgO (тв)
Оксид магния представляет собой ионное соединение, содержащее ионы Mg 2+ и O 2- , тогда как Mg (s) и O 2 (g) являются элементами без зарядов. Mg (s) с нулевым зарядом получает заряд +2, идущий от стороны реагента к стороне продукта, а O 2 (g) с нулевым зарядом получает заряд -2. Это потому, что когда Mg (s) становится Mg 2+ , он теряет 2 электрона. Поскольку на левой стороне находится 2 Mg, всего теряется 4 электрона в соответствии со следующей полуреакцией окисления:
- 2Mg (т) → 2Mg 2+ + 4e -
С другой стороны, O 2 был восстановлен: его степень окисления изменяется от 0 до -2. Таким образом, можно записать половину реакции восстановления для O 2, когда он приобретает 4 электрона:
- O 2 (г) + 4e - → 2O 2−
Общая реакция представляет собой сумму обеих половинных реакций:
- 2Mg (т) + O 2 (г) + 4e - → 2Mg 2+ + 2O 2− + 4e -
Когда происходит химическая реакция, особенно окислительно-восстановительная реакция, мы не видим электроны в том виде, в каком они появляются и исчезают в ходе реакции. Мы видим реагенты (исходный материал) и конечные продукты. Благодаря этому электроны, появляющиеся по обеим сторонам уравнения, сокращаются. После отмены уравнение переписывается как
- 2Mg (тв) + O 2 (г) → 2Mg 2+ + 2O 2-
На стороне продукта присутствуют два иона, положительный (Mg 2+ ) и отрицательный (O 2- ), и они немедленно объединяются, образуя сложный оксид магния (MgO) из-за их противоположных зарядов (электростатическое притяжение). В любой данной окислительно-восстановительной реакции есть две половинные реакции - полуреакция окисления и половина реакции восстановления. Сумма этих двух половинных реакций и есть реакция окисления-восстановления.
Метод балансировки половинной реакции
Рассмотрим реакцию ниже:
- Cl 2 + 2Fe 2+ → 2Cl - + 2Fe 3+
Два вовлеченных элемента, железо и хлор , каждый изменяют степень окисления; железо от +2 до +3, хлор от 0 до -1. Таким образом, фактически происходят две половинные реакции. Эти изменения можно представить формулами, вставив соответствующие электроны в каждую половину реакции:
- Fe 2+ → Fe 3+ + e -
- Cl 2 + 2e - → 2Cl -
Учитывая две половинные реакции, можно, зная соответствующие электродные потенциалы, таким же образом прийти к полной (исходной) реакции. Разложение реакции на половинные реакции является ключом к пониманию множества химических процессов. Например, в приведенной выше реакции можно показать, что это окислительно-восстановительная реакция, в которой Fe окисляется, а Cl восстанавливается. Обратите внимание на перенос электронов от Fe к Cl. Разложение - это также способ упростить балансировку химического уравнения . Химик может атомировать баланс и заряжать баланс по одной части уравнения за раз.
Например:
- Fe 2+ → Fe 3+ + e - превращается в 2Fe 2+ → 2Fe 3+ + 2e -
- добавляется к Cl 2 + 2e - → 2Cl -
- и, наконец, становится Cl 2 + 2Fe 2+ → 2Cl - + 2Fe 3+
Также возможно и иногда необходимо рассматривать половину реакции либо в основных, либо в кислых условиях, поскольку в окислительно-восстановительной реакции может присутствовать кислотный или основной электролит . Из-за этого электролита может быть труднее обеспечить баланс как атомов, так и зарядов. Это делается путем добавления H 2 O, OH - , e - или H + к любой стороне реакции до тех пор, пока атомы и заряды не уравновесятся.
Рассмотрим половину реакции ниже:
- PbO 2 → PbO
OH - , H 2 O и e - можно использовать для уравновешивания зарядов и атомов в основных условиях, если предполагается, что реакция протекает в воде.
- 2e - + H 2 O + PbO 2 → PbO + 2OH -
Снова рассмотрим половину реакции ниже:
- PbO 2 → PbO
H + , H 2 O и e - можно использовать для уравновешивания зарядов и атомов в кислых условиях, если предполагается, что реакция протекает в воде.
- 2e - + 2H + + PbO 2 → PbO + H 2 O
Обратите внимание, что обе стороны сбалансированы по заряду и по атомам.
Часто и H +, и OH - присутствуют в кислых и основных условиях, но в результате реакции двух ионов будет образовываться вода H 2 O (показано ниже):
- Н + + ОН - → Н 2 О