Парадокс Гиббса - Gibbs paradox
В статистической механике полуклассический вывод энтропии , который не принимает во внимание неразличимость частиц , дает выражение для энтропии, которое не является экстенсивным (не пропорционально количеству рассматриваемого вещества). Это приводит к парадоксу, известному как парадокс Гиббса , в честь Джозайи Уилларда Гиббса, который предложил этот мысленный эксперимент в 1874–1875 годах. Парадокс позволяет энтропии замкнутых систем уменьшаться, нарушая второй закон термодинамики . Связанный с этим парадокс - это « парадокс смешения ». Если принять точку зрения, что определение энтропии должно быть изменено, чтобы игнорировать перестановку частиц, парадокс устранен.
Иллюстрация проблемы
Сам Гиббс рассматривал следующую проблему, которая возникает, если энтропия идеального газа не является экстенсивной. Рядом стоят два одинаковых баллона с идеальным газом. Газ в контейнере №1 идентичен газу в контейнере №2 (т.е. по объему, массе, температуре, давлению и т. Д.). С каждым контейнером связана определенная энтропия S, которая зависит от объема каждого контейнера. Теперь дверца в стенке контейнера открывается, чтобы частицы газа могли смешиваться между контейнерами. Никаких макроскопических изменений не происходит, так как система находится в равновесии. Энтропия газа в системе двух контейнеров можно легко вычислить, но если уравнение не обширна, энтропия не будет 2 S . Фактически, величина неэкстенсивной энтропии, определенная и изученная Гиббсом, предсказывала бы дополнительную энтропию. Если закрыть дверь, то энтропия снова снизится до 2 S , что является предполагаемым нарушением второго закона термодинамики .
Как понял Гиббс и вновь подчеркнул в последнее время, это неправильное применение неэкстенсивной величины энтропии Гиббса. Если частицы газа различимы, закрытие дверей не вернет систему в исходное состояние - многие частицы переместятся в контейнеры. Есть свобода в том, что определяется как упорядоченное, и было бы ошибкой заключить, что энтропия не увеличилась. В частности, неэкстенсивное количество энтропии Гиббса для идеального газа не предназначалось для изменения числа частиц.
Парадокс устраняется заключением о неразличимости (по крайней мере, эффективной неразличимости) частиц в объеме. Это приводит к обширному уравнению Сакура – Тетрода для энтропии, которое выводится далее.
Вычисление энтропии идеального газа и ее обширное использование
В классической механике состояние идеального газа с энергией U , объемом V и с N частицами, каждая частица с массой m , представляется путем задания вектора импульса p и вектора положения x для каждой частицы. Это можно рассматривать как указание точки в 6N-мерном фазовом пространстве , где каждая из осей соответствует одной из координат импульса или положения одной из частиц. Набор точек в фазовом пространстве, которые может занимать газ, определяется ограничением, что газ будет иметь определенную энергию:
и содержаться внутри объема V (скажем, V - это куб со стороной X, так что V = X 3 ):
для и
Первое ограничение определяет поверхность 3N-мерного гиперсфере радиуса (2 мЕд ) 1/2 , а второй представляет собой 3N-мерный гиперкуб тома V N . В совокупности они образуют 6N-мерный гиперцилиндр. Так же, как площадь стенки цилиндра равна длине окружности основания, умноженной на высоту, так и площадь φ стенки этого гиперцилиндра равна:
Энтропия пропорциональна логарифму числа состояний, которые газ мог бы иметь, удовлетворяя этим ограничениям. В классической физике число состояний бесконечно велико, но согласно квантовой механике оно конечно. До появления квантовой механики эта бесконечность была регуляризована, сделав фазовое пространство дискретным. Фазовое пространство было разделено на блоки объема . Таким образом, постоянная h появилась в результате математической уловки и считалась не имеющей физического значения. Однако с помощью квантовой механики можно восстановить тот же формализм в полуклассическом пределе, но теперь с h, являющимся постоянной Планка. Качественно это можно увидеть из принципа неопределенности Гейзенберга ; объем в фазовом пространстве N меньше h 3N ( h - постоянная Планка) не может быть задан.
Чтобы вычислить количество состояний, мы должны вычислить объем в фазовом пространстве, в котором может быть найдена система, и разделить его на . Это приводит нас к другой проблеме: объем кажется приближающимся к нулю, поскольку область фазового пространства, в которой может находиться система, представляет собой область нулевой толщины. Эта проблема является артефактом задания энергии U с бесконечной точностью. В общей системе без симметрий полное квантовое рассмотрение привело бы к дискретному невырожденному набору собственных состояний энергии. Точная спецификация энергии затем зафиксировала бы точное состояние, в котором находится система, поэтому количество состояний, доступных для системы, будет равно единице, а энтропия, таким образом, будет равна нулю.
Когда мы определяем внутреннюю энергию как U , на самом деле мы имеем в виду, что полная энергия газа находится где-то в интервале длины около U. Здесь принято очень мало, оказывается, что энтропия не зависит сильно зависит от выбора при больших N . Это означает, что указанная выше «область» должна быть расширена до оболочки толщиной, равной неопределенности количества движения , поэтому энтропия определяется как:
где константа пропорциональности к , постоянная Больцмана . Используя приближение Стирлинга для гамма-функции, которое опускает члены меньшего порядка N , энтропия для больших N становится:
Это количество невелико, что можно увидеть, рассматривая два идентичных объема с одинаковым числом частиц и одинаковой энергией. Предположим, что вначале два объема разделены перегородкой. Удаление или повторная установка стены обратимо, но энтропия увеличивается, когда барьер удаляется на величину
что противоречит термодинамике, если вы снова установите барьер. Это парадокс Гиббса.
Парадокс разрешается, если постулировать, что частицы газа на самом деле неразличимы. Это означает, что все состояния, которые отличаются только перестановкой частиц, следует рассматривать как одно и то же состояние. Например, если у нас есть двухчастичный газ, и мы определяем AB как состояние газа, в котором первая частица ( A ) имеет импульс p 1, а вторая частица ( B ) имеет импульс p 2 , то это состояние, а также Б.А. состояние , в котором B частице имеет импульс р 1 и частица имеет импульс р 2 следует учитывать как и то же состояние.
Для газа из N- частиц существует N ! состояния, которые идентичны в этом смысле, если предположить, что каждая частица находится в отдельном состоянии отдельной частицы. Можно с уверенностью сделать это предположение, если газ не имеет чрезвычайно высокой плотности. Таким образом, при нормальных условиях можно рассчитать объем фазового пространства, занимаемого газом, разделив уравнение 1 на N !. Снова используя приближение Стирлинга для больших N , ln ( N! ) ≈ N ln ( N ) - N , энтропия для больших N равна:
который можно легко показать как обширный. Это уравнение Сакура – Тетрода .
Парадокс смешения
Парадокс, тесно связанный с парадоксом Гиббса, - это парадокс смешения . Фактически парадокс Гиббса - это частный случай «парадокса смешения», который содержит все характерные черты. Разница в том, что парадокс смешения имеет дело с произвольными различиями в двух газах, а не только с различиями в порядке частиц, как считал Гиббс. В этом смысле это прямое обобщение аргумента, изложенного Гиббсом. Снова возьмите ящик с перегородкой внутри, с газом A с одной стороны, газом B с другой стороны, и оба газа имеют одинаковую температуру и давление. Если газы A и B - разные газы, при смешивании газов возникает энтропия. Если газы одинаковые, дополнительная энтропия не рассчитывается. Дополнительная энтропия от смешения не зависит от характера газов; это зависит только от того, что газы разные. Два газа могут быть сколь угодно похожими, но энтропия от смешивания не исчезает, если они не являются одним и тем же газом - парадоксальная неоднородность.
Этот «парадокс» можно объяснить, внимательно изучив определение энтропии. В частности, как кратко объяснил Эдвин Томпсон Джейнс , определения энтропии произвольны.
Как указывает центральный пример в статье Джейнса, можно разработать теорию, которая рассматривает два газа как одинаковые, даже если эти газы в действительности можно различить посредством достаточно подробных измерений. Пока мы не проводим эти подробные измерения, теория не будет иметь внутренних противоречий. (Другими словами, не имеет значения, что мы называем газы A и B одним и тем же именем, если мы еще не обнаружили, что они различны.) Если наша теория называет газы A и B одинаковыми, то энтропия не изменяется, когда мы смешайте их. Если наши теории вызовы газов А и В различны, то энтропия делает увеличение , когда они смешиваются. Это понимание предполагает, что идеи «термодинамического состояния» и «энтропии» в некоторой степени субъективны.
Дифференциальное увеличение энтропии (dS) в результате смешивания разнородных газов, умноженное на температуру (T), равно минимальному количеству работы, которую мы должны сделать, чтобы восстановить газы в их исходное разделенное состояние. Предположим, что два газа разные, но мы не можем обнаружить их различия. Если эти газы находятся в коробке, отделенной друг от друга перегородкой, сколько работы потребуется для восстановления исходного состояния системы после того, как мы удалим перегородку и позволим газам смешаться?
Нет - просто вставьте раздел заново. Несмотря на то, что газы смешались, в системе никогда не было заметного изменения состояния, потому что, согласно гипотезе, газы экспериментально неразличимы.
Как только мы сможем различить газы, работа, необходимая для восстановления макроскопической конфигурации до смешивания из состояния после смешивания, станет отличной от нуля. Этот объем работы не зависит от того, насколько разные газы, а только от того, различимы ли они.
Эта линия рассуждений особенно информативна при рассмотрении концепций неразличимых частиц и правильного счета Больцмана . Первоначальное выражение Больцмана для количества состояний, доступных газу, предполагало, что состояние может быть выражено через несколько энергетических «подуровней», каждый из которых содержит определенное количество частиц. В то время как частицы на данном подуровне считались неотличимыми друг от друга, частицы на разных подуровнях считались отличимыми от частиц на любом другом подуровне. Это равносильно утверждению, что обмен двумя частицами на двух разных подуровнях приведет к обнаруживаемым разным «обменным макросостояниям» газа. Например, если мы рассмотрим простой газ с N частицами при достаточно низкой плотности, чтобы практически наверняка каждый подуровень содержал одну частицу или ни одной частицы (т.е. газ Максвелла – Больцмана), это означает, что простой контейнер с газом будет в одном из N! обнаруживаемые различные «макросостояния обмена», по одному для каждого возможного обмена частицами.
Подобно тому, как парадокс смешивания начинается с двух заметно разных контейнеров, и дополнительная энтропия, возникающая при смешивании, пропорциональна среднему количеству работы, необходимой для восстановления этого начального состояния после смешивания, так и дополнительная энтропия в исходном выводе Больцмана пропорциональна среднему значению объем работы, необходимый для восстановления простого газа из некоторого «обменного макросостояния» до его исходного «обменного макросостояния». Если мы предположим, что на самом деле нет экспериментально обнаруживаемой разницы в доступных «обменных макросостояниях», то использование энтропии, полученной в результате предположения, что частицы неразличимы, приведет к согласованной теории. Это «правильный счет Больцмана».
Часто говорят, что решение парадокса Гиббса происходит из того факта, что, согласно квантовой теории, подобные частицы в принципе неразличимы. Согласно рассуждениям Джейнса, если частицы экспериментально неразличимы по какой-либо причине, парадокс Гиббса разрешен, и квантовая механика дает только гарантию того, что в квантовой сфере эта неразличимость будет истинной в принципе, а не из-за недостаточно отработанная экспериментальная возможность.
Неэкстенсивная энтропия двух идеальных газов и как это исправить
В этом разделе мы представляем в общих чертах чисто классический вывод неэкстенсивной энтропии для идеального газа, рассмотренного Гиббсом до того, как будет учтен «правильный счет» (неразличимость частиц). Затем следует краткое обсуждение двух стандартных методов увеличения энтропии. Наконец, мы представляем третий метод, принадлежащий Р. Свендсену, для обширного (аддитивного) результата для энтропии двух систем, если им позволено обмениваться частицами друг с другом.
Настраивать
Мы представим упрощенный вариант расчета. Он отличается от полного расчета тремя способами:
- Идеальный газ состоит из частиц, ограниченных одним пространственным измерением.
- Мы сохраняем только условия порядка , отбрасывая все члены размера n или меньше, где n - количество частиц. Для наших целей этого достаточно, потому что именно здесь проявляется парадокс Гиббса и где его необходимо разрешить. Неучтенные члены играют роль, когда количество частиц не очень велико, например, в компьютерном моделировании и нанотехнологиях . Кроме того, они необходимы при выводе уравнения Сакура – Тетрода .
- Подразделение фазового пространства на единицы постоянной Планка (h) опущено. Вместо этого энтропия определяется с помощью интеграла по «доступной» части фазового пространства. Это подчеркивает чисто классический характер расчета.
Начнем с версии энтропии Больцмана, в которой все подынтегральное выражение является доступным фазовым пространством :
Интеграл ограничен контуром доступных областей фазового пространства при условии сохранения энергии. В отличие от одномерных линейных интегралов, встречающихся в элементарной физике, контур постоянной энергии имеет огромное количество измерений. Обоснование интегрирования по фазовому пространству с использованием канонической меры включает предположение о равновероятности. Это предположение может быть сделано с помощью эргодической гипотезы, а также теоремы Лиувилля о гамильтоновых системах.
(Эргодическая гипотеза лежит в основе способности физической системы достигать теплового равновесия , но это не всегда может быть верным для компьютерного моделирования (см. Проблему Ферми – Паста – Улама – Цинго ) или в некоторых реальных системах, таких как нетепловая плазма. .)
Теорема Лиувилля предполагает фиксированное количество измерений, которые система «исследует». В расчетах энтропии числовые измерения пропорциональны количеству частиц в системе, что заставляет фазовое пространство резко изменять размерность при добавлении или вычитании частиц. Это может объяснить трудности построения ясного и простого вывода для зависимости энтропии от числа частиц.
Для идеального газа доступным фазовым пространством является (n-1) -сфера (также называемая гиперсферой) в размерном пространстве:
Чтобы восстановить парадоксальный результат, заключающийся в том, что энтропия не является экстенсивной, мы интегрируем по фазовому пространству для газа одноатомных частиц, ограниченных одним пространственным измерением с помощью . Так как наша единственная цель , чтобы осветить парадокс, мы упростим обозначения, взяв массы частицы и постоянная Больцмана равна единице: . Мы представляем точки в фазовом пространстве и его x- и v- части n- и 2n- мерными векторами:
- где и
Для вычисления энтропии мы используем тот факт, что (n-1) -сфера имеет ( n - 1 ) -мерный «гиперповерхностный объем», равный
Например, если n = 2, 1-сфера - это круг , «гиперповерхность» на плоскости. Когда сфера четномерная ( n нечетная), необходимо будет использовать гамма-функцию, чтобы придать значение факториалу; увидеть ниже.
Парадокс Гиббса в одномерном газе
Парадокс Гиббса возникает, когда энтропия вычисляется с использованием размерного фазового пространства, где также есть количество частиц в газе. Эти частицы пространственно ограничены одномерным интервалом . Объем поверхности фиксированной энергии равен
Индексы на используются для определения «переменных состояния» и будут обсуждаться позже, когда будет утверждаться, что количество частиц не имеет полного статуса в качестве переменной состояния в этом вычислении. Интеграл по конфигурационному пространству равен . Как указано нижним ребром, интеграл по пространству скоростей ограничен «площадью поверхности» n - 1 мерной гиперсферы радиуса и, следовательно, равен «площади» этой гиперповерхности. Таким образом
Щелкните, чтобы просмотреть алгебраические шаги Начнем с: Оба термина в правой части имеют доминирующие термины. Используя приближение Стирлинга для больших M`` имеем:
Термины не учитываются, если они демонстрируют меньшее изменение с параметром, и мы сравниваем члены, которые меняются с одним и тем же параметром. Энтропия определяется аддитивной произвольной константой, потому что площадь в фазовом пространстве зависит от того, какие единицы измерения используются. По этой причине не имеет значения, велика или мала энтропия для данного значения E. Вместо этого мы ищем, как энтропия изменяется с E, т. Е. Ищем :
- Такое выражение, как гораздо менее важно, чем такое выражение, как
- Выражение "нравится" гораздо менее важно, чем выражение "нравится" . Обратите внимание, что логарифм не является сильно возрастающей функцией. Пренебрежение членами, пропорциональными n, по сравнению с членами, пропорциональными n ln n, оправдано только в том случае, если n чрезвычайно велико.
Объединяя важные термины:
После аппроксимации факториала и отбрасывания малых членов получаем
Во втором выражении термин вычитался и добавлялся, используя тот факт, что . Это было сделано для того, чтобы подчеркнуть, почему определенная здесь «энтропия» не может быть обширным свойством материи. Первые два члена являются обширными: если объем системы удваивается, но заполняется частицами той же плотности с той же энергией, то каждый из этих членов удваивается. Но третий член не является ни обширным, ни интенсивным, и поэтому неверен.
Произвольная константа была добавлена, потому что энтропию обычно можно рассматривать как определенную с точностью до произвольной аддитивной константы. Это особенно необходимо, когда энтропия определяется как логарифм объема фазового пространства, измеренный в единицах количества движения. Любое изменение в том, как эти единицы определены, будет добавлять или вычитать константу из значения энтропии.
Два стандартных способа расширить классическую энтропию
Как обсуждалось выше , обширная форма энтропии восстанавливается, если мы разделим объем фазового пространства на n !. Альтернативный подход состоит в том, чтобы утверждать, что зависимости от числа частиц нельзя доверять на том основании, что изменение также изменяет размерность фазового пространства. Такие изменения размерности выходят за рамки гамильтоновой механики и теоремы Лиувилля . По этой причине можно допустить, чтобы произвольная константа была функцией . Определяя функцию как , мы имеем:
- ,
который имеет обширное масштабирование:
Подход Свендсена с обменом частицами
Следуя Свендсену, мы позволяем двум системам обмениваться частицами. Это по существу «освобождает место» в фазовом пространстве для частиц, чтобы войти или покинуть его, не требуя изменения количества измерений фазового пространства. Общее количество частиц :
- частицы имеют координаты .
- Полная энергия этих частиц равна
- частицы имеют координаты .
- Полная энергия этих частиц равна
- Система подчиняется ограничениям, и
Взяв интеграл по фазовому пространству, имеем:
Знаки вопроса (?) Служат напоминанием , что мы не можем предположить , что первые п А частицы (то есть с 1 по п А ) находятся в Система- А в то время как другие частицы ( п Б через N ) находятся в Система- B . (Это более подробно обсуждается в следующем разделе.)
Логарифмируя и сохраняя только самые большие члены, получаем:
Это можно интерпретировать как сумму энтропии системы A и системы B, обеих обширных. И есть термин , который не является обширным.
Визуализация подхода с обменом частицами в трех измерениях
Правильные (обширные) формулы для систем A и B были получены, потому что мы включили все возможные способы, которыми две системы могут обмениваться частицами. Использование комбинаций (т.е. N частиц выбирают N A ) было использовано для определения количества способов, которыми N частиц можно разделить на систему A, содержащую n частиц A, и систему B, содержащую n частиц B. Этот подсчет оправдан не физическими причинами, а необходимостью интегрирования по фазовому пространству. Как будет показано ниже, фазовое пространство содержит не одну n A -сферу и одну n B -сферу, а вместо этого
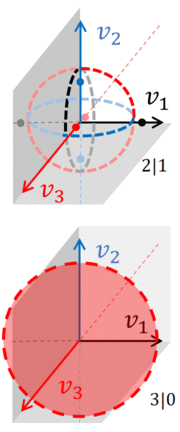
пары n -сфер, расположенных в одном N + 1-мерном пространстве скоростей. Интеграл по доступному фазовому пространству должен включать все эти n -сферы, как можно увидеть на рисунке, который показывает фактическое фазовое пространство скоростей, связанное с газом, состоящим из трех частиц. Более того, этот газ был разделен на две системы, A и B .
Если пренебречь пространственными переменными, фазовое пространство газа с тремя частицами будет трехмерным, что позволяет рисовать n-сферы, по которым должен быть взят интеграл по фазовому пространству. Если все три частицы вместе, разделение между двумя газами составляет 3 | 0. Доступное фазовое пространство ограничено обычной сферой ( 2-сферой ) с радиусом либо или (в зависимости от системы, содержащей частицы).
Если разбиение 2 | 1, то фазовое пространство состоит из кругов и точек . Каждый круг занимает два измерения, и для каждого круга две точки лежат на третьей оси, равноудаленной от центра круга. Другими словами, если система-A имеет 2 частицы, доступное фазовое пространство состоит из 3 пар n-сфер , каждая пара является 1-сферой и 0-сферой :
Обратите внимание, что
использованная литература
дальнейшее чтение
- Чжи-Юань Цзэн и Ариэль Катича (2001). «Еще одно разрешение парадокса Гиббса: подход теории информации». В Р.Л. Фрай (ред.). Байесовский вывод и методы максимальной энтропии в науке и технике . Материалы конференции AIP. 617 . п. 331. arXiv : cond-mat / 0109324 . DOI : 10.1063 / 1.1477057 .
- Дикс, Деннис (2011). «Возвращение к парадоксу Гиббса». В Деннисе Диксе; Венсеслао Х. Гонсалес; Стефан Хартманн ; Томас Убель; Марсель Вебер (ред.). Объяснение, прогноз и подтверждение . Философия науки в европейской перспективе. С. 367–377. arXiv : 1003.0179 . DOI : 10.1007 / 978-94-007-1180-8_25 . ISBN 978-94-007-1179-2. S2CID 118395415 .
внешние ссылки
- Парадокс Гиббса и его решения - сборник разнообразных статей











![S = kN \ ln \ left [V \ left ({\ frac UN} \ right) ^ {{{\ frac 32}}} \ right] + {{\ frac 32}} kN \ left (1+ \ ln { \ frac {4 \ pi m} {3h ^ {2}}} \ right)](https://wikimedia.org/api/rest_v1/media/math/render/svg/da9799b503f803ec6ef28c84d7eed8a6da7ea6d6)
![\ delta S = k \ left [2N \ ln (2V) -N \ ln VN \ ln V \ right] = 2kN \ ln 2> 0](https://wikimedia.org/api/rest_v1/media/math/render/svg/e13ea0ca707ae741436a3798802e851dfb2b9711)
![S = kN \ ln \ left [\ left ({\ frac VN} \ right) \ left ({\ frac UN} \ right) ^ {{{{\ frac 32}}} \ right] + kN \ left ({{ \ frac 52}} + {{\ frac 32}} \ ln {\ frac {4 \ pi m} {3h ^ {2}}} \ right)](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe5f53020fd0560e065341cb8b92cf552467b5d7)







![{\ vec \ xi} = [x_ {1}, ..., x_ {n}, v_ {1}, ..., v_ {n}] = [{\ vec x}, {\ vec v} \ ,]](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e4911e315b7413b929bc6838066382187e40498)
![{\ vec x} = [x_ {1}, ..., x_ {n}]](https://wikimedia.org/api/rest_v1/media/math/render/svg/b6894af4fba12d956d295aed5b9495fe35bbfd1a)
![{\ vec v} = [v_ {1}, ..., v_ {n}] \ ,.](https://wikimedia.org/api/rest_v1/media/math/render/svg/77388b68c975dce9ce125ec56cfb8a3ad2a8c7a0)








![\ ln \ Omega _ {{E, \ ell}} = \ ln \ left (\ ell ^ {n} n \ pi ^ {{n / 2}} (2E) ^ {{{\ frac {n-1}) {2}}}} \ right) - \ ln \ left [(n / 2)! \ Right]](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d4c1c3423647ad2d006b7dd2819ae84e2dbe6e9)



![{\ displaystyle {\ begin {align} - \ ln [(n / 2)!] & \ приблизительно - {\ frac {n} {2}} \ ln {\ frac {n} {2}} + {\ frac {n} {2}} - \ ln {\ sqrt {n \ pi}} \\ & = \ underbrace {- {\ frac {n} {2}} \ ln n} _ {\ text {keep}} + \ underbrace {{\ frac {n} {2}} \ ln 2 + {\ frac {n} {2}} - \ ln {\ sqrt {n \ pi}}} _ {\ text {drop}} \\ \ конец {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6bc7f2c97b7a0005b7eb2f689290dd5a0d4eb38a)