Тетрафторборат ферроцения - Ferrocenium tetrafluoroborate
|
|

|
|

|
|
| Имена | |
|---|---|
| Другие имена
дициклопентадиенил тетрафторборат железа
|
|
| Идентификаторы | |
|
3D модель ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.156.161 |
|
PubChem CID
|
|
|
Панель управления CompTox ( EPA )
|
|
|
|
| Свойства | |
| C 10 H 10 BFeF 4 | |
| Молярная масса | 272,84 г / моль |
| Внешность | темно-синий порошок |
| Температура плавления | 178 ° С (352 ° F, 451 К) (разлагается) |
| Растворимость в ацетонитриле | Растворимый |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| Пиктограммы GHS |

|
| Сигнальное слово GHS | Опасность |
| H314 | |
| P280 , P305 + 351 + 338 , P310 | |
| Родственные соединения | |
|
Родственные соединения
|
Ферроцен |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
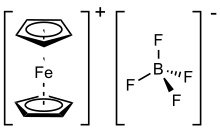
Тетрафторборат ферроцения представляет собой металлоорганическое соединение с формулой [Fe (C 5 H 5 ) 2 ] BF 4 . Эта соль состоит из катиона [Fe (C 5 H 5 ) 2 ] + и тетрафторборат- аниона ( BF-
4). Родственный гексафторфосфат также является популярным реагентом с аналогичными свойствами. Катион часто обозначается сокращенно Fc + или Cp 2 Fe + . Соль темно-синего цвета и парамагнитна . Соли ферроцения иногда используются в качестве одноэлектронных окислителей, а восстановленный продукт, ферроцен , инертен и легко отделяется от ионных продуктов. Пара ферроцен – ферроцений часто используется в качестве эталона в электрохимии. Стандартный потенциал ферроцена-ферроцения составляет 0,400 В по сравнению с нормальным водородным электродом (NHE) и часто считается неизменным для различных растворителей.
Подготовка
Имеющееся в продаже, это соединение может быть получено окислением ферроцена, как правило, солями трехвалентного железа с последующим добавлением фторборной кислоты . Также хорошо работают различные другие окислители, такие как нитрозилтетрафторборат . Известно много аналогичных солей ферроцения.
