Соединение диазония - Diazonium compound
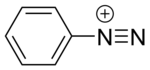
Соединения диазония или соли диазония представляют собой группу органических соединений, имеющих общую функциональную группу R-N.+
2Икс-
где R может быть любой органической группой, такой как алкил или арил , и X представляет собой неорганический или органический анион, такой как галоген .
Общие свойства и реакционная способность
Согласно приведенным в таблице константам линейной зависимости свободной энергии (например, Hammett σ m и σ p ) диазониевая группа (N 2 + ) является одним из наиболее сильно электроноакцепторных заместителей. Таким образом, α-положение разновидностей алкандиазония и кислых протонов на диазонио-замещенных фенолах и бензойных кислотах значительно снижает значения p K a по сравнению с их незамещенными аналогами. Например, водный p K a метандиазония оценивается как <10, в то время как для фенольного протона 4-гидроксибензолдиазония измеряется как 3,4.
Что касается реакционной способности, в химии солей диазония преобладает их склонность к дедиазотированию посредством термодинамически (энтальпийно и энтропийно) благоприятного вытеснения газообразного азота. Реакция (MeN 2 + → Me + + N 2 ) имеет изменение энтальпии 43 ккал / моль, в то время как (EtN 2 + → Et + + N 2 ) имеет изменение энтальпии 11 ккал / моль. Для вторичных и третичных разновидностей алкандиазония энтальпическое изменение рассчитано как близкое к нулю или отрицательное, с минимальным активационным барьером для вытеснения азота. Следовательно, вторичные и (особенно) третичные виды алкандиазония являются либо несвязанными, несуществующими видами, либо, в лучшем случае, чрезвычайно быстротечными промежуточными продуктами.
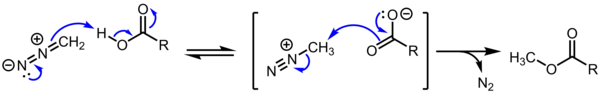
Карбоксилат метилдиазония считается мимолетным промежуточным продуктом в метилировании карбоновых кислот диазометаном , а формы алкандиазония, образующиеся в результате диазотирования аминов, изучались в исследованиях физической органической химии. Однако соли алкандиазония в остальном синтетически не важны из-за их чрезвычайной и неконтролируемой реакционной способности S N 2 / S N 1 / E1.
Напротив, соли арендиазония более стабильны, хотя все еще опасно взрывоопасны при определенных условиях, потому что S N 2 геометрически невозможен и не возникает, в то время как S N 1 возникает с гораздо большими трудностями по сравнению с формами алкандиазония из-за трудности образования высокоэнергетических соединений. арильный катион и более прочная связь C (sp 2 ) –N по сравнению со связью C (sp 3 ) –N в соединениях алкандиазония. Обычно хлоридную соль получают при 5 ° C из анилина и NaNO 2 / водн. Соли HCl и ArN 2 + Cl - имеют тенденцию к разложению (иногда со взрывом) при более высоких температурах. Однако использование редокс-неактивных и объемных HSO 4 - , BF 4 - или TsO - в качестве противоанионов позволило хранить соли арендиазония неограниченное время при 0 ° C и безопасно обращаться с ними в течение коротких периодов времени при температурах до 50 ° C. Соли арендиазония из-за S N 1 (Ar) (диссоциативное мономолекулярное нуклеофильное ароматическое замещение) в некоторых случаях, в то время как большинство их реакций протекает через S RN 1 (Ar) (диссоциативное радикальное нуклеофильное ароматическое замещение), в котором начальный перенос электрона имеет место, позволяя образовывать арильный радикал, а не катион.
Соли арендиазония - исключительно универсальные реагенты для химического синтеза. Поскольку арильные радикалы и катионы обладают высокой электрофильностью и будут реагировать практически с любым нуклеофильным реагентом, соли арендиазония образуют «транзитный узел» для химии аренов, из которого можно получить почти любое другое ароматическое производное. Более того, эта полезность подчеркивается их доступностью: соли арендиазония легко доступны в результате диазотирования ариламинов (анилинов и гетероариламинов), которые, в свою очередь, получают из исходного арена электрофильным нитрованием с последующим опосредованным или катализируемым металлом восстановлением. После электрофильного ароматического замещения химия диазония является наиболее часто применяемой стратегией для получения ароматических соединений.
Промышленно, арилдиазония соли являются важными промежуточными продуктами в органическом синтезе в азокрасителей . Разработан эффективный метод получения относительно стабильных солей диазония, стабилизированных их тозилатным противоанионом. Соединения были выделены и впоследствии использованы для синтеза выбранных азокрасителей.
Подготовка
Процесс образования диазониевых соединений называется «диазотированием», «диазонированием» или «диазотированием». Впервые об этой реакции сообщил Питер Грисс в 1858 году, который впоследствии открыл несколько реакций этого нового класса соединений. Чаще всего соли диазония получают обработкой ароматических аминов азотистой кислотой и дополнительной кислотой. Обычно азотистая кислота образуется in situ (в той же колбе) из нитрита натрия и избытка минеральной кислоты (обычно водной HCl, H 2 SO 4 , p -H 3 CC 6 H 4 SO 3 H или HBF 4 ):
Водные растворы солей хлорида диазония, традиционно получаемые из анилина, нитрита натрия и соляной кислоты, нестабильны при комнатной температуре и обычно готовятся при 0-5 ° C. Однако можно выделить соединения диазония в виде солей тетрафторбората или тозилата , которые являются стабильными твердыми веществами при комнатной температуре. Часто предпочтительно, чтобы соль диазония оставалась в растворе, но она имеет тенденцию к перенасыщению . Операторы были ранены или даже погибли в результате неожиданной кристаллизации соли с последующим ее взрывом.
Из-за этих опасностей соединения диазония обычно не выделяют. Вместо этого они используются на месте . Этот подход проиллюстрирован на примере получения аренсульфонильного соединения:
Реакции диазосочетания
Наиболее распространенной реакцией солей диазония является азосочетание . В этом процессе соединение диазония атакуется богатыми электронами субстратами, т. Е. Связывается с ними. Когда партнерами связывания являются арены, такие как анилины и фенолы, процесс является примером электрофильного ароматического замещения :
Другим коммерчески важным классом связывающих партнеров являются ацетоуксусные амиды, как показано на препарате Pigment Yellow 12, диарилидного пигмента .
Получающиеся азосоединения часто являются полезными красителями и фактически называются азокрасителями . Глубокие цвета красителей отражают их длительное сопряжение . Например, краситель, называемый желтым анилином, получают путем смешивания анилина и холодного раствора соли диазония и затем его энергичного встряхивания. Анилиновый желтый получают в виде твердого вещества желтого цвета. Точно так же холодный щелочной раствор нафтален-2-ола (бета-нафтол) дает интенсивный оранжево-красный осадок. Метиловый оранжевый - пример азокрасителя, который используется в лаборатории в качестве индикатора pH .
Смещение Н 2 группы
Катионы арендиазония претерпевают несколько реакций, в которых группа N 2 заменяется другой группой или ионом. Вот некоторые из основных.
Биариловая муфта
Пара катионов диазония может быть соединена с образованием биарилов . Это превращение иллюстрируется сочетанием соли диазония, полученной из антраниловой кислоты, с образованием дифеновой кислоты ((C 6 H 4 CO 2 H) 2 ). В родственной реакции та же соль диазония теряет N 2 и CO 2 с образованием бензина .
Замена на Halides
Реакция Сандмейера
Хлорид бензолдиазония, нагретый с хлоридом меди или бромидом одновалентной меди, соответственно растворенными в HCl или HBr, дает хлорбензол или бромбензол соответственно.
Реакция Гаттермана
В реакции Гаттермана хлорид бензолдиазония нагревают с медным порошком и HCl или HBr для получения хлорбензола и бромбензола соответственно. Он назван в честь немецкого химика Людвига Гаттерманна .
Замена йодидом
Катионы арендиазония реагируют с иодидом калия с образованием арилиодида :
Замена фторидом
Фторбензол получают термическим разложением фторбората бензолдиазония . Превращение называется реакцией Бальца-Шимана .
Традиционная реакция Бальца-Шимана была предметом многих мотивов, например, с использованием гексафторфосфатов (PF 6 - ) и гексафторантимоната (SbF 6 - ) вместо тетрафторборатов. Диазотирование можно проводить с помощью солей нитрозония, таких как [NO] SbF 6 .
Разные замены
Замена водородом
Катионы арендиазония, восстановленные гипофосфористой кислотой , этанолом или станнитом натрия, дают бензол:
Замена гидроксильной группой
Фенолы получают нагреванием водных растворов солей арендиазония:
Эта реакция носит немецкое название Phenolverkochung («варка с получением фенолов»). Образовавшийся фенол может реагировать с солью диазония, и, следовательно, реакция протекает в присутствии кислоты, которая подавляет эту дальнейшую реакцию. Гидроксилирование по типу Сандмейера также возможно с использованием Cu 2 O и Cu 2+ в воде.
Замена нитрогруппой
Нитробензол можно получить обработкой фторбората бензолдиазония нитритом натрия в присутствии меди. В качестве альтернативы диазотизация анилина может проводиться в присутствии закиси меди, которая генерирует нитрит меди in situ:
Замена на цианогруппу
Цианогруппа обычно не может быть введена нуклеофильным замещением галогенаренов , но такие соединения можно легко получить из солей диазония. Показательным является получение бензонитрила с использованием реактива цианида меди :
Эта реакция представляет собой особый тип реакции Зандмейера .
Замена трифторметильной группой
Две исследовательские группы сообщили о трифторметилировании солей диазония в 2013 году. Гуссен сообщил о получении комплекса CuCF 3 из CuSCN, TMSCF 3 и Cs 2 CO 3 . Напротив, Fu сообщил о трифторметилировании с использованием реагента Умемото ( S- трифторметилдибензотиофения тетрафторборат) и порошка Cu (условия типа Гаттермана). Их можно описать следующим уравнением:
Скобка указывает на то, что другие лиганды на меди, вероятно, присутствуют, но не указаны.
Замена тиоловой группой
Соли диазония можно превратить в тиолы в два этапа. Обработка хлорида бензолдиазония этилксантатом калия с последующим гидролизом промежуточного ксантогенатного эфира дает тиофенол :
Замена арильной группой
Арильная группа может быть связана с другой с использованием солей арендиазония. Например, обработка хлорида бензолдиазония бензолом (ароматическим соединением) в присутствии гидроксида натрия дает дифенил :
Эта реакция известна как реакция Гомберга – Бахмана . Подобное превращение также достигается обработкой хлорида бензолдиазония этанолом и медным порошком.
Замена боронатэфирной группой
Группа Bpin (пинаколатобор), используемая в реакциях кросс-сочетания Сузуки-Мияура , может быть установлена реакцией соли диазония с бис (пинаколато) дибороном в присутствии пероксида бензоила (2 мол.%) В качестве инициатора: Альтернативно подобное борилирование может быть достигнуто с использованием карбонильных комплексов переходных металлов, включая декакарбонил диманганца.
- C 6 H 5 N 2 + X - + контакт B – Bpin → C 6 H 5 Bpin + X – Bpin + N 2
Замена формильной группой
Формильная группа, CHO, может быть введена обработкой соли арилдиазония формальдоксимом (H 2 C = NOH) с последующим гидролизом арилальдоксима с образованием арилальдегида. Эта реакция известна как реакция Бука.
Реакция Меервейна
Хлорид бензолдиазония реагирует с соединениями, содержащими активированные двойные связи, с образованием фенилированных продуктов. Реакция называется арилированием Меервейна :
Металлические комплексы
Катионы диазония в своих реакциях с комплексами металлов ведут себя аналогично NO + . Например, комплексы низковалентных металлов добавляют с солями диазония. Иллюстративными комплексами являются [Fe (CO) 2 (PPh 3 ) 2 (N 2 Ph)] + и хиральный металл-комплекс Fe (CO) (NO) (PPh 3 ) (N 2 Ph).
Другие методы дедиазотизации
- путем органического снижения на электроде
- мягкими восстанавливающими агентами, такими как аскорбиновая кислота ( витамин С )
- с помощью гамма - излучения от сольватированных электронов , генерируемых в воде
- фотоиндуцированный перенос электронов
- восстановление катионами металлов, чаще всего солью меди .
- анион-индуцированная дедиазониация: противоион, такой как йод, передает электрон на катион диазония, образуя арильный радикал и йодный радикал
- вызванная растворителем дедиазониация с растворителем, выступающим в качестве донора электронов
Реакции прививки
В потенциальном применении в нанотехнологии соли диазония 4-хлорбензолдиазония тетрафторборат очень эффективно функционализируют одностенные нанотрубки . Чтобы расслоить нанотрубки, их смешивают с ионной жидкостью в ступке и пестиком . Соль диазония добавляется вместе с карбонатом калия , и после измельчения смеси при комнатной температуре поверхность нанотрубок покрывается хлорфенильными группами с эффективностью 1 из 44 атомов углерода. Эти добавленные заместители не позволяют трубкам образовывать тесные пучки из-за больших сил сцепления между ними, что является повторяющейся проблемой в технологии нанотрубок.
Также возможно функционализировать кремниевые пластины солями диазония, образующими арильный монослой. В одном исследовании поверхность кремния промывалась фтористым водородом аммония, оставляя ее покрытой кремний-водородными связями (гидридная пассивация). Реакция поверхности с раствором соли диазония в ацетонитриле в течение 2 часов в темноте является спонтанным процессом по свободнорадикальному механизму :
До настоящего времени прививка солей диазония на металлы осуществлялась на поверхности железа , кобальта , никеля , платины , палладия , цинка , меди и золота . Сообщалось также о прививке к алмазным поверхностям. Возникает один интересный вопрос - фактическое расположение арильной группы на поверхности. Исследование in silico показывает, что в периоде 4 элементов от титана до меди энергия связи уменьшается слева направо, потому что количество d-электронов увеличивается. Металлы слева от железа расположены под наклоном или плоско на поверхности, благоприятствуя образованию пи-связи металл-углерод, а металлы справа от железа расположены в вертикальном положении, благоприятствуя образованию сигма-связи металл-углерод . Это также объясняет, почему прививка соли диазония до сих пор была возможна с теми металлами, которые расположены справа от железа в периодической таблице .
Восстановление до гидразиновой группы
Соли диазония могут быть восстановлены хлоридом олова (SnCl 2 ) до соответствующих производных гидразина . Эта реакция является особенно полезной в синтезе Фишера синтеза индолов из триптан соединений и индометацин . Использование дитионита натрия является улучшением по сравнению с хлоридом олова, поскольку это более дешевый восстановитель с меньшими экологическими проблемами.
Биохимия
Ионы алкандиазония , которые редко встречаются в органической химии, считаются возбудителями канцерогенов. В частности, считается , что нитрозамины подвергаются метаболической активации с образованием разновидностей алкандиазония.
Приложения
Первое использование солей диазония заключалось в производстве водостойких окрашенных тканей путем погружения ткани в водный раствор соединения диазония с последующим погружением в раствор связующего вещества (богатое электронами кольцо, которое подвергается электрофильному замещению). Основное применение соединений диазония остается в промышленности красителей и пигментов.
Другое использование
Соединения диазония - стандартные реагенты, используемые при синтезе органических соединений , особенно арильных производных.
Соли диазония чувствительны к свету и разрушаются под воздействием ультрафиолетового или фиолетового света. Это свойство привело к их использованию при воспроизведении документов. В этом процессе бумага или пленка покрываются солью диазония. После контактного воздействия на свету остаточный диазокраситель с водным раствором связующего вещества превращается в стабильный азокраситель . В более распространенном процессе используется бумага, покрытая диазо, связующим и кислотой, чтобы препятствовать связыванию; после экспонирования изображение проявляется паровой смесью аммиака и воды, которая усиливает сцепление.
Безопасность
Твердые галогениды диазония часто опасно взрывоопасны, и сообщалось о смертельных случаях и травмах.
Природа анионов влияет на стабильность соли. Перхлораты арендиазония, такие как перхлорат нитробензолдиазония, использовались для инициирования взрывчатых веществ.
Смотрите также
использованная литература
реакция диазосочетания
внешние ссылки
- W. Reusch. «Реакции аминов» . Виртуальный текст органической химии . Университет штата Мичиган . Архивировано из оригинала на 2012-12-12.












![{\ Displaystyle {\ ce {[C6H5N + 2] BF4- -> C6H5F + BF3 + N2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98854fdc1405b490fdd0d68f060887ff90168c5b)
![{\ Displaystyle {\ ce {[C6H5N2 +] Cl- + H3PO2 + H2O -> C6H6 + N2 + H3PO3 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae4fe80352442662e0e0ea86f444c2e7e154a36a)
![{\ Displaystyle {\ ce {[C6H5N2 +] Cl- + CH3CH2OH -> C6H6 + N2 + CH3CHO + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1fd6aff8b1cca4b87fa0f2eb030d2df4b7521ff8)



![{\ Displaystyle {\ ce {C6H5N2 + + [CuCF3] -> C6H5CF3 + [Cu] + + N2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/186b334438ab68ac9d7c76d6da6d2c60b3bbf50d)


![{\ Displaystyle {\ ce {[C6H5N2 +] Cl- + C6H6 -> C6H5-C6H5 + N2 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/62f872781ba025ad2794380235783323c9a464c9)
![{\ displaystyle {\ ce {[C6H5N + 2] Cl- + ArCH = CHCOOH -> ArC = C-C6H5 + N2 + CO2 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c56c56d4d1da0b2573f3464b3f344c9c72cbf35e)
