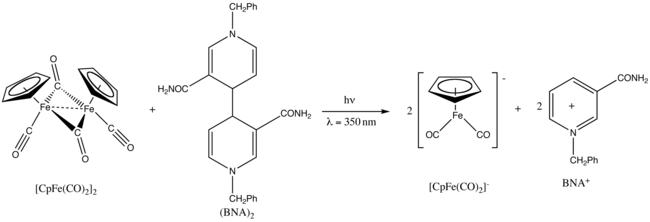
Циклопентадиенилдикарбонилдимер железа - Cyclopentadienyliron dicarbonyl dimer
|
|
|
|
|
|
| Имена | |
|---|---|
|
Название ИЮПАК
Ди-μ-карбонилдикарбонилбис (η 5 -циклопента-2,4-диен-1-ил) диирон
|
|
| Другие имена
Бис (циклопентадиенил) тетракарбонил-диирон,
ди (циклопентадиенил) тетракарбонил-диирон, бис (дикарбонилциклопентадиенил -железо ) |
|
| Идентификаторы | |
|
3D модель ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.032.057 |
| Номер ЕС | |
|
PubChem CID
|
|
|
|
|
|
| Характеристики | |
| C 14 H 10 Fe 2 O 4 | |
| Молярная масса | 353,925 г / моль |
| Появление | Темно-фиолетовые кристаллы |
| Плотность | 1,77 г / см 3 , твердый |
| Температура плавления | 194 ° С (381 ° F, 467 К) |
| Точка кипения | разложение |
| нерастворимый | |
| Растворимость в других растворителях | бензол, ТГФ, хлороуглероды |
| Состав | |
| искаженный восьмигранный | |
| 3,1 D (раствор бензола) | |
| Опасности | |
| Основные опасности | Источник CO |
| Пиктограммы GHS |
  
|
| Сигнальное слово GHS | Опасность |
| H228 , H302 , H331 , H330 | |
| Родственные соединения | |
|
Родственные соединения
|
Fe (C 5 H 5 ) 2 Fe (CO) 5 |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
Димер дикарбонила циклопентадиенильного железа представляет собой металлоорганическое соединение с формулой [( η 5 -C 5 H 5 ) Fe (CO) 2 ] 2 , часто сокращенно Cp 2 Fe 2 (CO) 4 , [CpFe (CO) 2 ] 2 или даже Fp 2 , с разговорным названием «фип димер». Это темно-красновато-пурпурное кристаллическое твердое вещество, легко растворимое в умеренно полярных органических растворителях, таких как хлороформ и пиридин , но менее растворимое в четыреххлористом углероде и сероуглероде . Cp 2 Fe 2 (CO) 4 нерастворим в воде, но устойчив по отношению к ней. Cp 2 Fe 2 (CO) 4 достаточно устойчив при хранении на воздухе и служит удобным исходным материалом для доступа к другим производным Fp (CpFe (CO) 2 ) (описанным ниже).
Состав
В растворе Cp 2 Fe 2 (CO) 4 можно рассматривать как димерный полусэндвич - комплекс. Он существует в трех изомерных формах: цис , транс и немостиковой открытой форме. Эти изомерные формы различаются положением лигандов. В цис и транс - изомеры различаются в относительном положении С 5 Н 5 (Cp) лигандов. В цис и транс - изомеры имеют формулировку [( η 5 -C 5 H 5 ) Fe (CO) ( μ -CO)] 2 , то есть два CO лиганды терминала , тогда как в двух других CO лиганды мостика между атомами железа. Цис и транс - изомеров взаимопревращаться через открытый изомер, который не имеет мостиковых лигандов между атомами железа. Вместо этого он сформулирован как ( η 5 -C 5 H 5 ) (OC) 2 Fe-Fe (CO) 2 ( η 5 -C 5 H 5 ) - металлы удерживаются вместе связью железо-железо. В равновесии преобладают цис- и транс- изомеры.
Кроме того, известно, что концевые и мостиковые карбонилы претерпевают обмен: транс- изомер может претерпевать обмен мостиково-концевого CO лиганда через открытый изомер или через скручивающее движение, не проходя через открытую форму. Напротив, мостиковые и концевые лиганды CO цис- изомера могут обмениваться только через открытый изомер.
В растворе цис- , транс- и открытые изомеры быстро взаимопревращаются при комнатной температуре, делая молекулярную структуру изменчивой . Процесс флюсирования для димера дикарбонила циклопентадиенилирования железа происходит быстрее, чем по шкале времени ЯМР, так что только усредненный одиночный сигнал Cp наблюдается в спектре 1 H ЯМР при 25 ° C. Аналогичным образом, спектр ЯМР 13 C показывает один резкий сигнал CO при температуре выше -10 ° C, в то время как сигнал Cp становится более резким до одного пика при температуре выше 60 ° C. Исследования ЯМР показывают, что цис- изомер немного больше, чем транс- изомер при комнатной температуре, в то время как количество открытой формы невелико. Процесс потока недостаточно быстр, чтобы произвести усреднение в ИК-спектре . Таким образом, для каждого изомера наблюдается три поглощения. Мостиковые лиганды CO появляются при около 1780 см -1, тогда как концевые лиганды CO наблюдаются при около 1980 см -1 . Усредненная структура этих изомеров Cp 2 Fe 2 (CO) 4 приводит к дипольному моменту 3,1 D в бензоле .
Твердотельная молекулярная структура цис- и транс- изомеров была проанализирована с помощью дифракции рентгеновских лучей и нейтронов . Разделение Fe – Fe и длины связей Fe – C одинаковы в ромбоидах Fe 2 C 2 , точно плоское четырехчленное кольцо Fe 2 C 2 в транс- изомере по сравнению со свернутым ромбоидом в цис с углом 164 °. , а также значительные искажения в Cp-кольце транс- изомера, отражающие различные популяции Cp-орбиталей. Хотя в старых учебниках показано, что два атома железа связаны друг с другом, теоретический анализ указывает на отсутствие прямой связи Fe – Fe. Эта точка зрения согласуется с расчетами и данными рентгеновской кристаллографии, которые указывают на отсутствие значительной электронной плотности между атомами железа. Однако Лабинджер предлагает иное мнение, основанное в первую очередь на химической реакционной способности и спектроскопических данных, утверждая, что электронная плотность не обязательно является лучшим показателем наличия химической связи. Более того, без связи Fe-Fe мостиковые карбонилы должны формально рассматриваться как лиганд μ-X 2 и лиганд μ-L, чтобы центры железа удовлетворяли правилу 18-электронов . Утверждается, что этот формализм вводит в заблуждение относительно химического и спектроскопического поведения карбонильных групп.
Синтез
Cp 2 Fe 2 (CO) 4 был впервые получен в 1955 году в Гарварде Джеффри Уилкинсоном с использованием того же метода, который используется сегодня: реакцией пентакарбонила железа и дициклопентадиена .
- 2 Fe (CO) 5 + C 10 H 12 → ( η 5 -C 5 H 5 ) 2 Fe 2 (CO) 4 + 6 CO + H 2
В этом препарате дициклопентадиен трескается с образованием циклопентадиена, который реагирует с Fe (CO) 5 с потерей CO . После этого пути фотохимического и теплового путей тонко различаются, но оба влекут за собой образование промежуточного гидрида . Метод используется в учебной лаборатории.
Реакции
Хотя Fp 2 не имеет большой коммерческой ценности, он является рабочей лошадкой в металлоорганической химии, поскольку он недорог, а производные FpX надежны (X = галогенид, органил).
«Fp - » (FpNa и FpK)
Восстановительное расщепление [CpFe (CO) 2 ] 2 (формально комплекс железа (I)) дает производные щелочного металла, формально производные циклопентадиенильного дикарбонильного аниона железа , [CpFe (CO) 2 ] - или называемые Fp - (формально железо (0) ), которые, как предполагается, существуют как плотная ионная пара . Типичным восстановителем является металлический натрий или амальгама натрия ; Использовались сплав NaK , графит калия (KC 8 ) и триалкилборгидриды щелочных металлов. [CpFe (CO) 2 ] Na - широко изученный реагент, поскольку он легко алкилируется, ацилируется или металлируется при обработке соответствующим электрофилом . Это превосходный нуклеофил S N 2, который на один-два порядка более нуклеофилен, чем тиофенолят, PhS - при взаимодействии с первичными и вторичными алкилбромидами.
- [CpFe (CO) 2 ] 2 + 2 Na → 2 CpFe (CO) 2 Na
- [CpFe (CO) 2 ] 2 + 2 KBH (C 2 H 5 ) 3 → 2 CpFe (CO) 2 K + H 2 + 2 B (C 2 H 5 ) 3
Лечение НСПП с алкильной галогенида (RX, X = Br, I) производит FER ( η 5 -C 5 H 5 ) (СО) 2
- CpFe (CO) 2 K + CH 3 I → CpFe (CO) 2 CH 3 + KI
Fp 2 можно также расщепить щелочными металлами и электрохимическим восстановлением .
FpX (X = Cl, Br, I)
Галогены окислительно расщепляют [CpFe (CO) 2 ] 2 с образованием Fe (II) разновидности FpX (X = Cl, Br, I):
- [CpFe (CO) 2 ] 2 + X 2 → 2 CpFe (CO) 2 X
Одним из примеров является иодид циклопентадиенил-железа .
Fp ( η 2 -алкен) + , Fp ( η 2 -алкин) + и другие "Fp + "
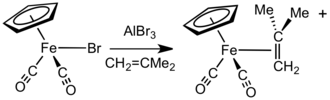
В присутствии акцепторов галогенид-анионов, таких как AlBr 3 или Ag BF 4 , соединения FpX (X = галогенид) реагируют с алкенами , алкинами или нейтральными лабильными лигандами (такими как простые эфиры и нитрилы ) с образованием комплексов Fp + . В другом подходе соли [Fp (изобутен)] + легко получить реакцией NaFp с хлористым металлом с последующим протонолизом. Этот комплекс является удобным и общим предшественником других катионных комплексов Fp – алкен и Fp – алкин. Процесс обмена облегчается за счет потери газообразного и объемного изобутена . Обычно менее замещенные алкены связываются сильнее и могут замещать более затрудненные алкеновые лиганды. Алкеновые и алкиновые комплексы также могут быть получены нагреванием катионного эфира или водного комплекса, например [Fp ( thf )]+
BF-
4, с алкеном или алкином. [FpL]+
BF-
4Комплексы также могут быть получены обработкой FpMe HBF 4 · Et 2 O в CH 2 Cl 2 при -78 ° C с последующим добавлением L.
Комплексы алкен – Fp также могут быть получены из аниона Fp косвенно. Таким образом, отщепление гидридов от Fp – алкильных соединений с использованием трифенилметилгексафторфосфата дает комплексы [Fp (α-алкен)] + .
- FpNa + RCH 2 CH 2 I → FpCH 2 CH 2 R + NaI
- FpCH 2 CH 2 R + Ph 3 CPF 6 → [Fp (CH
2= CHR)+
]ПФ-
6 + Ph 3 CH
Реакция NaFp с эпоксидом с последующей кислотной дегидратацией также дает алкеновые комплексы. Fp (алкен) + стабильны по отношению к бромированию , гидрированию и ацетоксимеркурации , но алкен легко высвобождается с йодидом натрия в ацетоне или при нагревании с ацетонитрилом .
Алкеновый лиганд в этих катионах активируется в направлении атаки нуклеофилами , открывая путь для ряда реакций образования углерод-углеродных связей . Нуклеофильные присоединения обычно происходят у более замещенного атома углерода. Эта региохимия объясняется большей плотностью положительного заряда в этом положении. Regiocontrol часто скромны. Добавление нуклеофила полностью стереоселективно и происходит против группы Fp. Сообщается также, что аналогичные комплексы Fp (алкин) + претерпевают реакции нуклеофильного присоединения с помощью различных нуклеофилов углерода, азота и кислорода.
Π-комплексы Fp (алкен) + и Fp (алкин) + также являются достаточно кислотными в аллильном и пропаргильном положениях, соответственно, и могут быть количественно депротонированы аминовыми основаниями, такими как Et 3 N, с образованием нейтрального Fp-аллила и Fp-алленила σ -комплексы (ур.1).
- (1) Fp (H
2C = CHCH
2CH
3)+
BF-
4+ Et 3 N → FpCH 2 CH = CHCH 3 + Et
3NH+
BF-
4 - (2) FpCH 2 CH = CHCH 3 + E+
BF-
4→ Fp (H
2C = CHCH ( E ) CH
3)+
BF-
4
Fp-аллил и Fp-алленил реагируют с катионными электрофилами E (такими как Me 3 O + , карбокатионы , ионы оксокарбения ) с образованием продуктов функционализации аллила и пропаргила соответственно (уравнение 2). Было показано, что родственный комплекс [Cp * Fe (CO) 2 (thf)] + [BF 4 ] - катализирует пропаргиловую и аллильную C-H-функционализацию путем комбинирования процессов депротонирования и электрофильной функционализации, описанных выше.
η 2 -алленильные комплексы Fp + и замещенных циклопентадиенильных дикарбонильных катионов железа также были охарактеризованы с помощью рентгеноструктурного анализа, показавшего существенный изгиб у центрального алленового углерода (валентный угол <150 °).
Реагенты циклопропанирования на основе фп
Реагенты на основе ФП разработаны для циклопропанирования . Ключевой реагент готовится из FpNa с тиоэфиром и метилиодидом и имеет хороший срок хранения, в отличие от типичных промежуточных продуктов Симмонса-Смита и диазоалканов .
- FpNa + ClCH 2 SCH 3 → FpCH 2 SCH 3 + NaCl
- FpCH 2 SCH 3 + CH 3 I + NaBF 4 → FpCH 2 S (CH 3 ) 2 ] BF 4 + NaI
Использование [FpCH 2 S (CH 3 ) 2 ] BF 4 не требует специальных условий.
-
Fp (CH
2S+
(CH
3)
2) BF-
4 + (Ph) 2 C = CH 2 → 1,1-дифенилциклопропан +…
Хлорид железа (III) добавляется для уничтожения побочных продуктов.
Предшественники Fp = CH+
2подобно FpCH 2 OMe, который превращается в карбен железа при протонировании, также использовались в качестве реагентов циклопропанирования.
Фотохимическая реакция
Fp 2 демонстрирует фотохимию . При УФ- облучении при длине волны 350 нм он восстанавливается димером 1-бензил-1,4-дигидроникотинамида (BNA) 2 .



![Добавление карбаниона к [Fp (алкен)] +.](https://upload.wikimedia.org/wikipedia/commons/thumb/7/7e/FpMalonateRxn.png/330px-FpMalonateRxn.png)