Дикобальт октакарбонил - Dicobalt octacarbonyl

|
|
|
|

|
|
| Имена | |
|---|---|
|
Название ИЮПАК
Октакарбонилдикобальт ( Co — Co )
|
|
| Другие имена
Карбонил кобальта, диму-карбонилгексакарбонилдикобальт, октакарбонил кобальта, димер тетракарбонила кобальта, карбонил дикобальта, октакарбонилдикобальт
|
|
| Идентификаторы | |
|
3D модель ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.030.454 |
| Номер ЕС | |
|
PubChem CID
|
|
| Номер RTECS | |
| UNII | |
| Номер ООН | 3281 |
|
Панель управления CompTox ( EPA )
|
|
|
|
|
|
| Характеристики | |
| Co 2 (CO) 8 | |
| Молярная масса | 341,95 г / моль |
| Появление | красно-оранжевые кристаллы белое кристаллическое твердое вещество в чистом виде |
| Плотность | 1,87 г / см 3 |
| Температура плавления | От 51 до 52 ° C (от 124 до 126 ° F, от 324 до 325 K) |
| Точка кипения | 52 ° C (126 ° F, 325 K) приблизительно разлагается |
| нерастворимый | |
| Давление газа | 0,7 мм рт. Ст. (20 ° C) |
| Состав | |
| 1,33 D (C 2v изомер) 0 D (D 3d изомер) |
|
| Опасности | |
| Основные опасности | Очень токсичен, при разложении выделяет газообразный CO, пирофорный, канцерогенный |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| Пиктограммы GHS |
   
|
| Сигнальное слово GHS | Опасность |
| H228 , H251 , H302 , H312 , H315 , H317 , H319 , H330 , H334 , H350 , H351 , H361 , H412 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Пирофорный |
| NIOSH (пределы воздействия на здоровье в США): | |
|
PEL (Допустимо)
|
никто |
|
REL (рекомендуется)
|
TWA 0,1 мг / м 3 |
|
IDLH (Непосредственная опасность)
|
ND |
| Родственные соединения | |
|
Родственные карбонилы металлов
|
Пентакарбонил железа Дийрон нонакарбонил Тетракарбонил никеля |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
Дикобальт октакарбонил - это металлоорганическое соединение состава Co 2 (CO) 8 . Этот карбонил металла используется в качестве реагента и катализатора в металлоорганической химии и органическом синтезе и является центральным элементом широко известной химии кобальта . Это предшественник катализатора гидроформилирования , тетракарбонилгидрида кобальта . Каждая молекула состоит из двух атомов кобальта, связанных с восемью лигандами монооксида углерода , хотя известно несколько различных структурных расположений. Некоторые карбонильные лиганды очень лабильны . Соединение обладает высокой реакционной способностью по отношению к алкинам и иногда используется в качестве защитной группы для алкинов . В качестве кобальта алкиновой комплексы, он играет роль в развитии как реакции Николая и реакции Pauson-Кханде .
Синтез, строение, свойства
Дикобальт октакарбонил представляет собой белое твердое вещество высокой чистоты, но чаще представляет собой пирофорное твердое вещество оранжевого цвета, которое термически нестабильно. Он синтезируется карбонилированием под высоким давлением солей кобальта (II) . В методе, запатентованном Джеймсом Эли Кнапом, ацетат кобальта (II) нагревают до температуры от 150 до 200 ° C и подвергают воздействию водорода и угарного газа под давлением от 2000 до 6000 фунтов на квадратный дюйм :
- 2 Co (CH 3 CO 2 ) 2 + 8 CO + 2 H 2 → Co 2 (CO) 8 + 4 CH 3 COOH
Приготовление часто проводят в присутствии цианида , превращая соль кобальта (II) в комплекс гексацианокобальтата (II), который затем обрабатывают монооксидом углерода с получением K [Co (CO) 4 ]. В результате подкисления образуется тетракарбонилгидрид кобальта , HCo (CO) 4 , который затем может быть нагрет до октакарбонила дикобальта. Его также можно получить, нагревая металлический кобальт до температуры выше 250 ° C в потоке газообразного монооксида углерода при давлении примерно от 200 до 300 атм :
- 2 Co + 8 CO → Co 2 (CO) 8
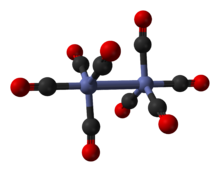
Известно, что он существует в нескольких изомерных формах, все с одинаковым составом - [Co 2 (CO) 8 ] - с двумя центрами металлического кобальта в нулевой степени окисления, окруженными восемью карбонильными (CO) лигандами . Эти лиганды могут быть преодоление между двумя центрами кобальта или связанными с одной металлическим центром (а терминал лиганда ). В растворе известны два изомера, которые быстро взаимопревращаются:
Главный изомер (слева в приведенном выше равновесном процессе) содержит два мостиковых карбонильных лиганда, связывающих центры кобальта, и шесть концевых карбонильных лигандов, по три на каждый металл. Его можно описать формулой (CO) 3 Co (μ-CO) 2 Co (CO) 3 и имеет симметрию C 2v . Эта структура напоминает нонакарбонил ди-железа (Fe 2 (CO) 9 ), но с одним мостиковым карбонилом меньше. Расстояние Co – Co составляет 2,52 Å, а концевые расстояния Co – CO и мостиковые расстояния Co – CO составляют 1,80 и 1,90 Å соответственно. Анализ связи предполагает отсутствие прямой связи кобальт-кобальт.
Минорный изомер не имеет мостиковых карбонильных лигандов, но вместо этого имеет прямую связь между центрами кобальта и восемью концевыми карбонильными лигандами, по четыре на каждый атом металла. Его можно описать формулой (CO) 4 Co-Co (CO) 4 и он имеет симметрию D 4d . Он имеет немостиковую связь кобальт-кобальт, длина которой составляет 2,70 Å в твердой структуре при кристаллизации вместе с C 60 .
Реакции
Снижение
Октакарбонил дикобальта восстанавливается щелочными металлами и соответствующими реагентами. Полученные соли щелочных металлов протонируются с образованием гидрида тетракарбонилкобальта :
- Co 2 (CO) 8 + 2 Na → 2 NaCo (CO) 4
- NaCo (CO) 4 + H + → HCo (CO) 4 + Na +
Реакции с электрофилами
Галогены и родственные реагенты расщепляют связь Co-Co с образованием пентакоординированных галотетракарбонилов:
- Co 2 (CO) 8 + Br 2 → 2 BrCo (CO) 4
Трикарбонил нитрозил кобальта получают обработкой октакарбонила дикобальта оксидом азота:
- Co 2 (CO) 8 + 2 NO → 2 Co (CO) 3 NO + 2 CO
Николай реакция
Реакция Николаса - это реакция замещения, при которой алкоксигруппа, расположенная на α-углероде алкина , заменяется другим нуклеофилом . Алкин сначала вступает в реакцию с октакарбонилом дикобальта, из которого образуется стабилизированный пропаргильный катион, который реагирует с поступающим нуклеофилом, а затем образуется продукт путем окислительной деметаллизации .
Реакция Паусона-Ханда
Реакция Паусона-Ханда , в которой алкин , алкен и монооксид углерода циклизуются с образованием циклопентенона , может катализироваться Co 2 (CO) 8 , хотя с тех пор были разработаны более новые методы, которые более эффективны:
Co 2 (CO) 8 реагирует с алкинами с образованием стабильного ковалентного комплекса, который используется в качестве защитной группы для алкина. Сам этот комплекс также может быть использован в реакции Паусона – Ханда.
Возможны внутримолекулярные реакции Паусона – Ханда, в которых исходный материал содержит как алкеновые, так и алкиновые фрагменты. В асимметрическом синтезе в Lycopodium алкалоид Huperzine-Q , Takayama и сотрудники использовали внутримолекулярную реакцию Pauson-Кханд к cyclise в enyne , содержащую трут - бутилдифенилсилил (TBDPS) защищенный первичный спирт. Получение циклического силоксанового фрагмента непосредственно перед введением октакарбонила дикобальта обеспечивает образование продукта с желаемой конформацией .

Шаг 1 : диссоциация окиси углерода из гидрида кобальта тетракарбонила с образованием HCO (СО) 3 , активные каталитические частицы
Шаг 2 : Центр кобальта образует π-связь с алкеном
Этап 3 : Алкеновый лиганд вставляется в связь кобальт-гидрид
Этап 4 : Координация дополнительного карбонильного лиганда
Этап 5 : Мигрирующее введение карбонильного лиганда в связь кобальт-алкил, превращая алкильная тетракарбонил промежуточная в ацил видов трикарбонила
Шаг 6 : Окислительное добавление из дигидрофосфата приводит к dihydrido комплекса
Шага 7 : альдегидный продукту выпущенного восстановительным элиминирования , регенерирующее активные каталитические частицы
Шага 8 : непродуктивная и обратимая побочная реакция
Гидроформилирование
Гидрирование Co 2 (CO) 8 дает тетракарбонилгидрид кобальта, [HCo (CO) 4 ]:
- Co 2 (CO) 8 + H 2 → 2 HCo (CO) 4
Этот гидрид используется в качестве катализатора для гидроформилирования - превращения терминального алкена , RCH = СН 2 , к альдегид , RCH 2 CH 2 CHO. Каталитический цикл для этого гидроформилирования показано на рисунке.
Снижение Co 2 (CO) 8 с амальгамой натрия дает сопряженное основание из HCO (CO) 4 . Эта соль дает гидрид при подкислении, обеспечивая альтернативный путь синтеза для этого вида. Соли этой формы также являются промежуточными продуктами в пути синтеза цианида октакарбонила дикобальта.
- Co 2 (CO) 8 + 2 Na → 2 NaCo (CO) 4
- NaCo (CO) 4 + H + → HCo (CO) 4 + Na +
Лиганды CO можно заменить третичными фосфиновыми лигандами с получением Co 2 (CO) 8− x (PR 3 ) x . Эти объемные производные являются более селективными катализаторами реакций гидроформилирования. « Жесткие » основания Льюиса, например пиридин , вызывают диспропорционирование :
- 12 C 5 H 5 N + 3 Co 2 (CO) 8 → 2 [Co (C 5 H 5 N) 6 ] [Co (CO) 4 ] 2 + 8 CO

Нонакарбонилы трикобальта
Нагревание вызывает декарбонилирование и образование додекакарбонила тетракобальта :
- 2 Co 2 (CO) 8 → Co 4 (CO) 12 + 4 CO
Как и многие карбонилы металлов, октакарбонил дикобальта отделяет галогениды от алкилгалогенидов. При взаимодействии с бромоформом он превращается в метилидинетрикобальтнонакарбонил , HCCo 3 (CO) 9 , посредством реакции, которую можно идеализировать как:
- 9 Co 2 (CO) 8 + 4 CHBr 3 → 4 HCCo 3 (CO) 9 + 36 CO + 6 CoBr 2
Рентгеновский кристаллографический анализ показывает, что продукт содержит треугольник из атомов кобальта на расстояниях около 2,48 Å, каждый из которых связан с тремя концевыми карбонильными группами, и с группой метилидина (СН), образующей вершину треугольной пирамиды. Этот продукт структурно связан с додекакарбонилтетракобальт, теоретически, заменив группу methylidyne четвертым Co (CO) 3 фрагмента . Тем не менее, существует разногласие между теорией и экспериментом с фактической структурой додекакарбонила тетракобальта, которая, как было показано, имеет три мостиковые карбонильные группы.
Безопасность
Co 2 (CO) 8, летучий источник кобальта (0), пирофорен и при разложении выделяет окись углерода . Национальный институт по безопасности и гигиене труда было рекомендовано , чтобы работники не должны подвергаться воздействию концентрации более 0,1 мг / м 3 в течение восьмичасового времени средневзвешенный, без надлежащего дыхательного механизма.
использованная литература
- ^ a b c d e f g h Карманное руководство NIOSH по химической опасности. «# 0147» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b Паусон, Питер Л .; Стамбули, Джеймс П .; Чжоу, Дэ-Чанг; Хонг, Бор-Чернг (2014). «Октакарбонилдикобальт». Энциклопедия реагентов для органического синтеза . Джон Вили и сыновья . DOI : 10.1002 / 047084289X.ro001.pub3 .
- ^ a b c d e f g h i j Дональдсон, Джон Даллас; Бейерсманн, Детмар (2005). «Соединения кобальта и кобальта». Энциклопедия промышленной химии Ульмана . Wiley-VCH. DOI : 10.1002 / 14356007.a07_281.pub2 .
- ^ a b c d Elschenbroich, C .; Зальцер, А. (1992). Металлоорганические соединения: краткое введение (2-е изд.). Вайнхайм: Wiley-VCH . ISBN 3-527-28165-7.
- ^ a b c d Свини, Рэй Л .; Браун, Теодор Л. (1977). «Инфракрасные спектры матрично-изолированного октакарбонила дикобальта. Доказательства третьего изомера». Неорганическая химия . 16 (2): 415–421. DOI : 10.1021 / ic50168a037 .
- ^ a b c Николас, Кеннет М. (1987). «Химия и синтетическая полезность пропаргильных катионов в комплексе с кобальтом». В соотв. Chem. Res. (Рассмотрение). 20 (6): 207–214. DOI : 10.1021 / ar00138a001 .
- ^ a b c Теобальд, Барри Дж. (2002). «Реакция Николая: использование пропаргиловых катионов, стабилизированных гексакарбонилом дикобальта, в синтезе». Тетраэдр (Обзор). 58 (21): 4133–4170. DOI : 10.1016 / S0040-4020 (02) 00315-0 .
- ^ a b c Паусон, Польша ; Khand, IU (1977). «Использование комплексов кобальт-карбонилацетилен в органическом синтезе». Анна. NY Acad. Sci. 295 (1): 2–14. DOI : 10.1111 / j.1749-6632.1977.tb41819.x .
- ^ а б Бланко-Ургоити, Хайме; Аньорбе, Лорето; Перес-Серрано, Летисия; Домингес, Хема; Перес-Кастельс, Хавьер (2004). «Реакция Паусона-Ханда, мощный синтетический инструмент для синтеза сложных молекул». Chem. Soc. Ред. 33 (1): 32–42. DOI : 10.1039 / b300976a .
- ^ Патент США 3236597 , Knap, Джеймс Эли, "высокочистый октакарбонилдикобальт", опубликованный 22 февраля 1966 года, назначен Union Carbide Corporation
- ^ a b Орчин, Милтон (1953). «Гидрирование органических соединений синтез-газом». Достижения в катализе . 5 . Академическая пресса . С. 385–415. ISBN 9780080565095.
- ^ Самнер, Г. Гарднер; Klug, Harold P .; Александр, Лерой Э. (1964). «Кристаллическая структура октакарбонила дикобальта». Acta Crystallographica . 17 (6): 732–742. DOI : 10.1107 / S0365110X64001803 .
- ^ Грин, Дженнифер С .; Грин, Малькольм LH ; Паркин, Жерар (2012). «Возникновение и представление трехцентровых двухэлектронных связей в ковалентных неорганических соединениях». Химические коммуникации . 2012 (94): 11481–11503. DOI : 10.1039 / c2cc35304k .
- ^ Гарсия, Thelma Y .; Феттингер, Джеймс С.; Олмстед, Мэрилин М .; Балч, Алан Л. (2009). «Великолепная симметрия: кристаллизация немостикового изомера Co 2 (CO) 8 в Co 2 (CO) 8 · C 60 ». Химические коммуникации . 2009 (46): 7143–7145. DOI : 10.1039 / b915083h .
- ^ Локвуд, Роза Ф .; Николас, Кеннет М. (1977). «Ионы карбения, стабилизированные переходными металлами, как синтетические промежуточные продукты. I. Ионы α - [(алкинил) дикобальта гексакарбонил] карбения в качестве пропаргилирующих агентов». Tetrahedron Lett. 18 (48): 4163–4165. DOI : 10.1016 / S0040-4039 (01) 83455-9 .
- ^ Николай, KM; Петтит Р. (1972). «О стабильности гексакарбонилкарбониевых ионов α- (алкинил) дикобальта». J. Organomet. Chem. 44 (1): C21 – C24. DOI : 10.1016 / 0022-328X (72) 80037-8 .
- ^ Шор, Нил Э. (1991). "Реакция циклоприсоединения Паусона-Ханда для синтеза циклопентенонов". Орг. Реагировать. 40 : 1. doi : 10.1002 / 0471264180.or040.01 .
- ^ Гибсон, Сьюзен Э .; Стивенацци, Андреа (2003). «Реакция Паусона – Ханда: настал каталитический век!». Энгью. Chem. Int. Эд. 42 (16): 1800–1810. DOI : 10.1002 / anie.200200547 .
- ^ Накаяма, Ацуши; Когуре, Нориюки; Китадзима, Марико; Такаяма, Хиромицу (2011). «Асимметричный полный синтез пентациклического алкалоида ликоподия : гуперзин-Q». Энгью. Chem. Int. Эд. 50 (35): 8025–8028. DOI : 10.1002 / anie.201103550 .
- Перейти ↑ Ho, Tse-Lok (2016). «Дикобальт октакарбонил» . Реагенты Физера для органического синтеза . 28 . Джон Вили и сыновья . С. 251–252. ISBN 9781118942819.
- ^ a b Черт, Ричард Ф .; Бреслоу, Дэвид С. (1961). «Реакция гидротетракарбонила кобальта с олефинами». Журнал Американского химического общества . 83 (19): 4023–4027. DOI : 10.1021 / ja01480a017 .
- ^ a b Халперн, Джек (2001). «Металлоорганическая химия на пороге нового тысячелетия. Ретроспектива и перспективы» . Чистая и прикладная химия . 73 (2): 209–220. DOI : 10,1351 / pac200173020209 .
- ^ a b Pfeffer, M .; Греллье, М. (2007). «Металлоорганические соединения кобальта». Комплексная металлоорганическая химия III . 7 . Эльзевир . С. 1–119. DOI : 10.1016 / B0-08-045047-4 / 00096-0 .
- ^ Чини, П. (1968). «Замкнутые карбонильные кластеры металлов». Обзоры Inorganica Chimica Acta . 2 : 31–51. DOI : 10.1016 / 0073-8085 (68) 80013-0 .
- ^ Nestle, Mara O .; Hallgren, John E .; Сейферт, Дитмар; Доусон, Питер; Робинсон, Брайан Х. (1980). «μ 3 -метилидин и μ 3- бензилидин-трис (трикарбонилкобальт)». Неорг. Synth. 20 : 226–229. DOI : 10.1002 / 9780470132517.ch53 .
- ^ Leung, P .; Coppens, P .; Макмаллан, РК; Koetzle, TF (1981). «Структура нонакарбонил-μ 3 -метилидин- триангулотрикобальта . Рентгеноструктурные и нейтронографические исследования». Acta Crystallogr. B . 37 (7): 1347–1352. DOI : 10.1107 / S0567740881005906 .
- ^ Коррадини, Паоло (1959). «Строение тетракобальтдодекарбонила». Журнал химической физики . 31 (6): 1676–1677. DOI : 10.1063 / 1.1730674 .
- ^ Вэй, Цзинь Сюань (1969). «Структурный анализ додекакарбонила тетракобальта и додекакарбонила тетрародия. Кристаллографические обработки неупорядоченной структуры и двойникового композита». Неорганическая химия . 8 (11): 2384–2397. DOI : 10.1021 / ic50081a030 .
- ^ Фарруджа, Луи Дж .; Брага, Дарио; Грепиони, Фабриция (1999). «Повторное определение структуры Co 4 (CO) 12 : свидетельство динамического беспорядка и пути миграции атомов металла в кристаллической фазе». Журнал металлоорганической химии . 573 (1–2): 60–66. DOI : 10.1016 / S0022-328X (98) 00879-1 .
- ^ Коул Пармер MSDS
- ^ CDC - Карманный справочник NIOSH по химическим опасностям





