Сульфат кадмия - Cadmium sulfate
|
|
| Имена | |
|---|---|
|
Название ИЮПАК
Сульфат кадмия (II)
|
|
| Другие имена
Серная кислота, кадмиевая соль (1: 1),
|
|
| Идентификаторы | |
|
3D модель ( JSmol )
|
|
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.030.288 |
| Номер ЕС | |
| 8295 | |
|
PubChem CID
|
|
| Номер RTECS | |
| UNII | |
| Номер ООН | 2570 |
|
Панель управления CompTox ( EPA )
|
|
|
|
|
|
| Свойства | |
| CdSO 4 CdSO 4 · H 2 O (моногидрат) 3CdSO 4 · 8H 2 O (октагидрат) |
|
| Молярная масса | 208,47 г / моль (безводный) 226,490 г / моль (моногидрат) 769,546 г / моль (октагидрат) |
| Внешность | Белое гигроскопичное твердое вещество |
| Запах | без запаха |
| Плотность | 4,691 г / см 3 (безводный) 3,79 г / см 3 (моногидрат) 3,08 г / см 3 (октагидрат) |
| Температура плавления | 1000 ° C (1830 ° F; 1270 K) (безводный) 105 ° C (моногидрат) 40 ° C (октагидрат) |
| Точка кипения | (разлагается на основной сульфат, а затем на оксид) |
|
безводный: 75 г / 100 мл (0 ° C) 76,4 г / 100 мл (25 ° C) 58,4 г / 100 мл (99 ° C) моногидрат: 76,7 г / 100 мл (25 ° C) октагидрат: очень растворим |
|
| Растворимость | мало растворим в метаноле , этилацетат не растворим в этаноле |
| -59,2 · 10 −6 см 3 / моль | |
|
Показатель преломления ( n D )
|
1,565 |
| Структура | |
| орторомбический (безводный) моноклинный (гепта и октагидрат) |
|
| Термохимия | |
|
Стандартная мольная
энтропия ( S |
123 Дж · моль −1 · K −1 |
|
Std энтальпия
формации (Δ F H ⦵ 298 ) |
−935 кДж · моль −1 |
| Опасности | |
| Паспорт безопасности | [1] |
| Пиктограммы GHS |
  
|
| Сигнальное слово GHS | Опасность |
| H301 , H330 , H340 , H350 , H360 , H372 , H400 , H410 | |
| Р201 , Р202 , Р260 , Р264 , Р270 , Р271 , Р273 , Р281 , Р284 , Р301 + 310 , Р304 + 340 , P308 + 313 , P310 , P314 , P320 , P321 , P330 , P391 , P403 + 233 , Р405 , Р501 | |
| NFPA 704 (огненный алмаз) | |
| Смертельная доза или концентрация (LD, LC): | |
|
LD 50 ( средняя доза )
|
280 мг / кг (перорально, крыса) |
| NIOSH (пределы воздействия на здоровье в США): | |
|
PEL (Допустимо)
|
[1910.1027] TWA 0,005 мг / м 3 (как Cd) |
|
REL (рекомендуется)
|
Ca |
|
IDLH (непосредственная опасность)
|
Ca [9 мг / м 3 (в виде Cd)] |
| Родственные соединения | |
|
Другие анионы
|
Кадмий ацетат , хлорид кадмия , нитрат кадмия |
|
Другие катионы
|
Сульфат цинка , сульфат кальция , магния сульфат |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
Сульфат Кадмий является именем ряда родственных неорганических соединений с формулой ЭПРО 4 · х Н 2 О. Наиболее распространенной формой является моногидрат ЭПРО 4 · Н 2 О, а две другие формы , как известно ЭПРО 4 · 8 / 3 H 2 O и безводная соль (CdSO 4 ). Все соли бесцветны и хорошо растворяются в воде.
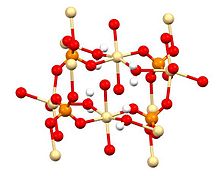
Структура, подготовка и возникновение
Рентгеновская кристаллография показывает, что CdSO 4 · H 2 O является типичным координационным полимером. Каждый центр Cd 2+ имеет октаэдрическую координационную геометрию , будучи окруженным четырьмя кислородными центрами, обеспечиваемыми четырьмя сульфатными лигандами и двумя кислородными центрами из мостиковых лигандов воды .
Октогидрат сульфата кадмия может быть получен реакцией металлического кадмия или его оксида или гидроксида с разбавленной серной кислотой:
- CdO + H 2 SO 4 → CdSO 4 + H 2 O
- Cd + H 2 SO 4 → CdSO 4 + H 2
Безводный материал готовят с использованием персульфата натрия :
- Cd + Na 2 S 2 O 8 → CdSO 4 + Na 2 SO 4
Чистый сульфат кадмия встречается в виде очень редких минералов дробекит (CdSO 4 · 4H 2 O), воудуризит (моногидрат) и лазаридизит (8/3-гидрат).
Приложения
Сульфат кадмия широко используется для гальваники кадмия в электронных схемах. Он также является предшественником пигмента на основе кадмия, такого как сульфид кадмия . Он также используется в качестве электролита в стандартной ячейке Weston, а также в качестве пигмента в флуоресцентных экранах.
Ссылки
- ^ Лиде, Дэвид Р., изд. (2006). CRC Справочник по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press . ISBN 0-8493-0487-3.
- ^ a b Zumdahl, Стивен С. (2009). Химические принципы 6-е изд . Компания Houghton Mifflin. п. A21. ISBN 978-0-618-94690-7.
- ^ a b c Карманный справочник NIOSH по химической опасности. «# 0087» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Theppitak, C /; Чайнок, К. «Кристаллическая структура CdSO 4 (H 2 O): новое определение» Acta Crystallographica, раздел E. Отчеты о структуре в Интернете, 2015 г., том 71, pi8-pi9. DOI : 10,1107 / S2056989015016904

