Бластоциста - Blastocyst
| Бластоциста | |
|---|---|
 Бластоциста непосредственно перед имплантацией
| |
 Бластоциста человека с внутренней клеточной массой вверху справа
| |
| Подробности | |
| Этап Карнеги | 3 |
| Дни | 5–9 |
| Дает начало | Гаструла |
| Идентификаторы | |
| латинский | Бластоцисты |
| MeSH | D001755 |
| TE | E2.0.1.2.0.0.12 |
| FMA | 83041 |
| Анатомическая терминология | |
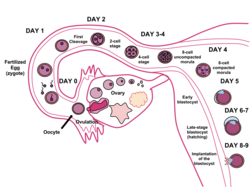
Бластоцисты является структурой , образованной в начале развития млекопитающих . Он обладает внутренней клеточной массой (ICM), которая впоследствии формирует эмбрион . Внешний слой бластоцисты состоит из клеток, которые вместе называются трофобластом . Этот слой окружает внутреннюю клеточную массу и заполненную жидкостью полость, известную как бластоцель . Трофобласт дает начало плаценте . Название «бластоциста» происходит от греческих βλαστός blastos («росток») и κύστις kystis («мочевой пузырь, капсула»). У других животных это называется бластулой .
У людей образование бластоцисты начинается примерно через 5 дней после оплодотворения, когда заполненная жидкостью полость открывается в моруле , ранней эмбриональной стадии шара из 16 клеток. Бластоциста имеет диаметр около 0,1–0,2 мм и включает 200–300 клеток после быстрого расщепления (деления клеток). Примерно через семь дней после оплодотворения бластоциста проходит имплантацию , встраивание в эндометрий на стенке матки . Там он претерпит дальнейшие процессы развития, в том числе гаструляцию . Встраивание бластоцисты в эндометрий требует, чтобы она вылуплялась из блестящей оболочки , что предотвращает прикрепление к фаллопиевой трубе, когда преэмбрион продвигается к матке.
Использование бластоцист при экстракорпоральном оплодотворении (ЭКО) включает культивирование оплодотворенной яйцеклетки в течение пяти дней перед переносом ее в матку. Это может быть более эффективный метод лечения бесплодия, чем традиционное ЭКО. Внутренняя клеточная масса бластоцист является источником эмбриональных стволовых клеток , которые широко применяются в терапии стволовыми клетками, включая восстановление, замену и регенерацию клеток.
Цикл разработки
Во время эмбрионального развития человека , примерно через 5-6 дней после оплодотворения , клетки морулы начинают подвергаться клеточной дифференцировке , и морула превращается в бластоцисту. В матке блестящая оболочка, окружающая бластоцисту, разрушается, что позволяет ей имплантироваться в стенку матки примерно через 6 дней после оплодотворения. Имплантация знаменует конец зародышевого этапа эмбриогенеза.
Образование бластоцисты
Зиготы развивается митоза , и когда она превратилась в 16 клеток становится известным как морулы . До этой стадии развития все клетки ( бластомеры ) автономны и не зависят от какой-либо судьбы. У многих животных морула затем развивается в результате кавитации и становится бластулой. Затем при клеточной дифференцировке клетки бластулы делятся на два типа: клетки трофобласта, окружающие бластоцель, и внутреннюю массу клеток (эмбриобласт). Концептус тогда известен как бластоциста. Сторона бластоцисты, где образуется внутренняя клеточная масса, называется животным полюсом, а противоположная сторона - вегетативным полюсом. Внешний слой клеток трофобласта, возникающий в результате уплотнения, закачивает ионы натрия в бластоцист, что заставляет воду проникать через осмос и формировать внутреннюю заполненную жидкостью полость бластоцисты (бластоцель). Бластоцель, клетки трофобласта и клетки внутренней клеточной массы являются отличительными чертами бластоцисты.
Имплантация
Имплантация имеет решающее значение для выживания и развития раннего эмбриона человека. Он устанавливает связь между матерью и ранним эмбрионом, которая будет сохраняться до конца беременности. Имплантация стала возможной благодаря структурным изменениям как бластоцисты, так и стенки эндометрия. В пеллюциде окружающего бластоцистов нарушений, именуемое вылупление . Это снимает ограничение на физический размер эмбриональной массы и открывает внешние клетки бластоцисты внутренней части матки. Кроме того, гормональные изменения у матери, в частности пик лютеинизирующего гормона (ЛГ), подготавливают эндометрий к приему и обволакиванию бластоцисты. Иммунная система также модулируется для обеспечения вторжения иностранных эмбриональных клеток. После связывания с внеклеточным матриксом эндометрия клетки трофобласта секретируют ферменты и другие факторы, чтобы внедрить бластоцисту в стенку матки. Высвобождаемые ферменты разрушают слизистую оболочку эндометрия, в то время как аутокринные факторы роста, такие как хорионический гонадотропин человека (ХГЧ) и инсулиноподобный фактор роста (ИФР), позволяют бластоцисте проникать в эндометрий.
Имплантация в стенку матки позволяет перейти к следующему этапу эмбриогенеза - гаструляции , которая включает образование плаценты из трофобластических клеток и дифференциацию внутренней клеточной массы в амниотический мешок и эпибласт .
Состав
Есть два типа бластомерных клеток:
- Внутренняя клеточная масса, также известная как эмбриобласт , дает начало примитивной энтодерме и собственно эмбриону (эпибласту).
- Примитивная энтодерма развивается в амниотический мешок, который образует заполненную жидкостью полость, в которой находится эмбрион во время беременности.
- Эпибласт дает начало трем зародышевым листкам развивающегося эмбриона во время гаструляции ( энтодерма , мезодерма и эктодерма ).
- Трофобласт - это слой клеток, образующий внешнее кольцо бластоцисты, который соединяется с материнским эндометрием, образуя плаценту. Клетки трофобласта также секретируют факторы, образующие бластоцель.
- После имплантации цитотрофобласт представляет собой внутренний слой трофобласта, состоящий из стволовых клеток, которые дают начало клеткам, включающим ворсинки хориона , плаценту и синцитиотрофобласт .
- После имплантации синцитиотрофобласт - это самый внешний слой трофобласта. Эти клетки секретируют протеолитические ферменты, разрушающие внеклеточный матрикс эндометрия, что позволяет имплантировать бластоцисты в стенку матки.
Полость жидкости бластоцеля содержит аминокислоты , факторы роста и другие молекулы, необходимые для дифференцировки клеток .
Спецификация ячейки
Множественные процессы контролируют спецификацию клеточных клонов в бластоцисте для производства трофобласта, эпибласта и примитивной энтодермы. Эти процессы включают экспрессию генов, клеточную сигнализацию, межклеточный контакт и позиционные отношения, а также эпигенетику .
Как только ICM устанавливается в бластоцисте, эта клеточная масса готовится к дальнейшей спецификации в эпибласт и примитивную энтодерму. Этот процесс спецификации частично определяется передачей сигналов фактора роста фибробластов (FGF), который генерирует путь киназы MAP для изменения клеточных геномов. Дальнейшая сегрегация бластомеров на трофобласт и внутреннюю клеточную массу регулируется гомеодоменным белком Cdx2 . Этот фактор транскрипции подавляет экспрессию факторов транскрипции Oct4 и Nanog в трофобласте . Эти геномные изменения делают возможной прогрессивную спецификацию клонов как эпибластов, так и примитивной энтодермы в конце фазы развития бластоцисты, предшествующей гаструляции. Большая часть исследований, проводимых на этих ранних эмбриональных стадиях, проводится на эмбрионах мышей, и конкретные факторы могут различаться у разных млекопитающих.
Во время имплантации трофобласт дает начало экстраэмбриональным мембранам и типам клеток, которые в конечном итоге сформируют большую часть плаценты плода, специализированного органа, через который эмбрион получает материнское питание, необходимое для последующего экспоненциального роста. Спецификация трофобласта контролируется комбинацией морфологических сигналов, возникающих из клеточной полярности с дифференциальной активностью сигнальных путей, таких как Hippo и Notch, и ограничением внешними клетками спецификаторов клонов, таких как CDX2.
У мышей, первичные зародышевые клетки определяются из эпибласта клеток, процесс , который сопровождается обширным геном -ный эпигенетическим перепрограммирования. Репрограммирование включает глобальное деметилирование ДНК и реорганизацию хроматина, приводящую к тотипотентности клетки . Процесс деметилирования в масштабе всего генома включает в себя путь эксцизионной репарации оснований ДНК .
Трофобласты экспрессируют интегрин на своих клеточных поверхностях, что обеспечивает адгезию к внеклеточному матриксу стенки матки. Это взаимодействие делает возможной имплантацию и запускает дальнейшую спецификацию в трех разных типах клеток, подготавливая бластоцисту для гаструляции.
Клинические последствия
Тесты на беременность
Уровень хорионического гонадотропина человека, секретируемый бластоцистой во время имплантации, является фактором, измеряемым в тесте на беременность . ХГЧ можно измерить как в крови, так и в моче, чтобы определить, беременна ли женщина. Больше ХГЧ секретируется при многоплодной беременности. Анализы крови на ХГЧ также можно использовать для проверки аномальной беременности.
Экстракорпоральное оплодотворение
Экстракорпоральное оплодотворение (ЭКО) является альтернативой традиционномуоплодотворению in vivo для оплодотворения яйцеклетки спермой и имплантации этого эмбриона в матку женщины. В течение многих лет эмбрион вводили в матку через два-три дня после оплодотворения. Однако на этой стадии развития очень трудно предсказать, какие эмбрионы будут развиваться лучше всего, и обычно имплантировалось несколько эмбрионов. Несколько имплантированных эмбрионов увеличили вероятность развития плода, но также привели к развитию нескольких плодов. Это была серьезная проблема и недостаток использования эмбрионов в ЭКО.
Использование бластоцист для экстракорпорального оплодотворения человека оказалось успешным. Бластоциста имплантируется через пять-шесть дней после оплодотворения яиц. Через пять или шесть дней намного легче определить, какие эмбрионы приведут к здоровым живорожденным. Знание того, какие эмбрионы будут успешными, позволяет имплантировать только одну бластоцисту, что резко снижает риск для здоровья и расходы, связанные с многоплодием. Теперь, когда определены потребности в питательных веществах для развития эмбриона и бластоцисты, гораздо проще дать эмбрионам правильные питательные вещества, чтобы поддержать их в фазе бластоцисты.
Имплантация бластоцисты после экстракорпорального оплодотворения - это безболезненная процедура, при которой катетер вводится во влагалище, проводится через шейку матки с помощью ультразвука в матку, где бластоцисты вводятся в матку.
Бластоцисты также обладают преимуществом, поскольку их можно использовать для генетического тестирования клеток на предмет генетических проблем. В бластоцисте достаточно клеток, чтобы можно было удалить несколько клеток трофэктодермы, не нарушая развивающуюся бластоцисту. Эти клетки могут быть проверены на анеуплоидию хромосом с использованием доимплантационного генетического скрининга (PGS) или определенных состояний, таких как муковисцидоз , часто известного как преимплантационная генетическая диагностика (PGD).
Смотрите также
использованная литература
![]() Эта статья включает общедоступный текст из 20-го издания «Анатомии Грея» (1918 г.).
Эта статья включает общедоступный текст из 20-го издания «Анатомии Грея» (1918 г.).
внешние ссылки