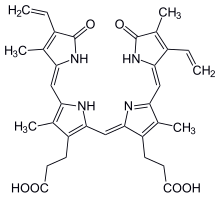
Биливердин - Biliverdin
|
|
| Имена | |
|---|---|
|
Название ИЮПАК
3,3 '- (2,17-диэтил-3,7,13,18-тетраметил-1,19-диоксо-19,21,22,24-тетрагидро- 1H- билин-8,12-диил) дипропановая кислота кислота
|
|
|
Предпочтительное название IUPAC
3,3 ′ - ([1 2 (2) Z , 4 (5 2 ) Z , 6 (7 2 ) Z ] -1 3 , 7 4- дифенил-1 4 , 3 3 , 5 4 , 7 3 -тетраметил -1 5 , 7 5 -диоксо-1 1 , 1 5 , 7 1 , 7 5 -тетрагидро-3 1 H -1,7 (2), 3,5 (2,5) -тетрапирролагептафан-1 2 (2) , 4 (5 2 ), 6 (7 2 ) -триен-3 4 , 5 3 -диил) дипропановая кислота |
|
| Идентификаторы | |
|
3D модель ( JSmol )
|
|
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard |
100,003,675 |
| MeSH | Биливердин |
|
PubChem CID
|
|
| UNII | |
|
Панель управления CompTox ( EPA )
|
|
|
|
|
|
| Характеристики | |
| С 33 H 34 N 4 O 6 | |
| Молярная масса | 582,646 |
| Температура плавления | > 300 ° С |
| Опасности | |
| Основные опасности | Раздражающий |
| Паспорт безопасности | Сигма-Олдрич |
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
|
|
|
|
| Ссылки на инфобоксы | |
Биливердин - зеленый тетрапирроловый желчный пигмент , продукт катаболизма гема . Это пигмент, который придает зеленоватый оттенок синякам .
Метаболизм
Биливердин результатов распада гема фрагмента гемоглобина в эритроцитах . Макрофаги расщепляют стареющие эритроциты и расщепляют гем на биливердин вместе с гемосидерином , в котором биливердин обычно быстро превращается в свободный билирубин .
Биливердин на короткое время появляется в некоторых синяках зеленого цвета. В синяках его распад на билирубин приводит к желтоватому цвету.
Роль в болезни
Биливердин был обнаружен в избытке в крови людей, страдающих заболеваниями печени. Желтуха вызывается накоплением биливердина или билирубина (или обоих) в системе кровообращения и тканях. Желтуха кожи и склеры (белки глаз) характерны для печеночной недостаточности.
Роль в лечении болезни
Обычно считается, что это просто отходы распада гема, но количество данных, свидетельствующих о том, что биливердин и другие желчные пигменты играют физиологическую роль в организме человека, растет.
Желчные пигменты, такие как биливердин, обладают значительными антимутагенными и антиоксидантными свойствами и, следовательно, могут выполнять полезную физиологическую функцию. Было показано, что биливердин и билирубин являются мощными поглотителями гидропероксильных радикалов . Также было показано, что они подавляют действие полициклических ароматических углеводородов , гетероциклических аминов и окислителей - все они являются мутагенами . Некоторые исследования показали, что люди с более высокими уровнями концентрации билирубина и биливердина в организме имеют более низкую частоту рака и сердечно-сосудистых заболеваний . Было высказано предположение, что биливердин, как и многие другие тетрапирролические пигменты, может действовать как ингибитор протеазы ВИЧ-1 , а также оказывать положительное действие при астме, хотя для подтверждения этих результатов необходимы дальнейшие исследования. В настоящее время нет практических результатов использования биливердина для лечения каких-либо заболеваний.
У нечеловеческих животных
Биливердин является важным пигментным компонентом скорлупы птичьих яиц, особенно синей и зеленой скорлупы. В синей яичной скорлупе содержится значительно более высокая концентрация биливердина, чем в коричневой яичной скорлупе.
Исследования показали, что биливердин яичной скорлупы вырабатывается из скорлупы, а не в результате распада эритроцитов в кровотоке, хотя нет никаких доказательств того, что источником материала являются ни тетрапирролы, ни свободный гем из плазмы крови.
Наряду с его присутствием в скорлупе птичьих яиц, другие исследования также показали, что биливердин присутствует в сине-зеленой крови многих морских рыб, крови табачного рогатого червя , крыльях моли и бабочки, сыворотке и яйцах лягушек и плацента собак. В очень редких случаях у собак это может привести к рождению щенков с зеленой шерстью; однако зеленый цвет тускнеет вскоре после рождения. У саргана ( Belone belone ) и родственных видов кости ярко-зеленые из-за биливердина.
Биливердин также присутствует в зеленой крови, мышцах, костях и слизистой оболочке сцинков рода Prasinohaema , обитающих в Новой Гвинее . Неясно, является ли это присутствие биливердина экологической или физиологической адаптацией какого-либо рода. Было высказано предположение, что накопление биливердина может сдерживать опасную инфекцию, вызываемую малярийными паразитами Plasmodium , хотя статистически значимой корреляции не установлено. Камбоджийская лягушка Chiromantis samkosensis также демонстрирует эту характеристику наряду с бирюзовыми костями.
В флюоресцентной визуализации

В комплексе с модифицированным бактериальным фитохромом биливердин был использован в качестве хромофора, излучающего ИК-излучение, для визуализации in vivo. В отличии от флуоресцентных белков , которые образуют их хромофор пути посттрансляционных модификаций в полипептидной цепи , фитохромы связывания внешнего лиганда (в данном случае, биливердин) и успешной визуализации первого bacteriophytochrome на основе зонда требуется добавление экзогенного биливердина. Недавние исследования показали, что флуоресцентные белки на основе бактериофитохрома с высоким сродством к биливердину можно визуализировать in vivo с использованием только эндогенного лиганда и, таким образом, с той же легкостью, что и обычные флуоресцентные белки. Появление второго и последующих поколений зондов на основе биливердин-связывающих бактериофитохромов должно расширить возможности неинвазивной визуализации in vivo.
Новый класс флуоресцентного белка был эволюционировал от цианобактерий ( Trichodesmium erythraeum ) фикобилипротеин , α- аллофикоцианин , и назван малый ультра - красный флуоресцентный белок ( smURFP ) в 2016 году smURFP аутокаталитически себя включают хромофор биливердина без необходимости внешнего белка , известный как лиаза . Флуоресцентные белки, производные от медуз и кораллов, требуют кислорода и производят стехиометрическое количество перекиси водорода при образовании хромофора . smURFP не требует кислорода и не производит перекись водорода и использует хромофор биливердин. smURFP имеет большой коэффициент экстинкции (180000 M −1 см −1 ) и умеренный квантовый выход (0,20), что делает его биофизическую яркость сопоставимой с eGFP и примерно в 2 раза ярче, чем у большинства красных или дальних красных флуоресцентных белков, полученных из коралл . Спектральные свойства smURFP аналогичны органическому красителю Cy5 .

